Актуальные проблемы анестезиологии, реаниматологии и интенсивной терапии. Материалы научной конференции. Под редакцией В.И. Cтрашнова. Санкт-Петербург, 2001
Содержание
- ВОПРОСЫ ЭФФЕРЕНТНОЙ ТЕРАПИИ СЕПТИЧЕСКИХ
ОСЛОЖНЕНИЙ
В.А. Воинов, А.Ю.Дубикайтис, К.С. Карчевсий, С.Г.Конюхова, И.В.Либов
ГНЦ пульмонологии МЗ РФ, СПбГМУ имени академика И.П. Павлова - АКТУАЛЬНОСТЬ ИССЛЕДОВАНИЯ И ЛЕЧЕНИЯ БОЛЕВЫХ
СИНДРОМОВ. ОБЗОР МАТЕРИАЛОВ ПО ИЗУЧЕНИЮ БОЛИ
В.А. Волчков, В. И. Страшное
СПбГМУ имени академика И.П. Павлова - ВИДЫ АНЕСТЕЗИОЛОГИЧЕСКОГО ОБЕСПЕЧЕНИЯ В
ОПЕРАТИВНОЙ УРОЛОГИИ
В. А. Волчков, С.Х. Аль-Шукри, В.А. Красногоров
СП6ГМУ имени академика И.П.Павлова
ВОПРОСЫ ЭФФЕРЕНТНОЙ ТЕРАПИИ СЕПТИЧЕСКИХ
ОСЛОЖНЕНИЙ
В.А. Воинов, А.Ю.Дубикайтис, К.С. Карчевсий,
С.Г.Конюхова, И.В.Либов
ГНЦ пульмонологии МЗ РФ, СПбГМУ имени академика
И.П. Павлова
В патогенезе септических осложнений и развивающейся последующей полиорганной недостаточности существенную роль играет эндотоксемия, возникновение которой зависит от эндо- и экзотоксинов возбудителей, проникающих из первичного очага инфекции в кровоток, а также целой цепи последующих метаболических нарушений — калликреин-кининовой системы и перекисного окисления липидов с накоплением токсичных конечных продуктов, протеолитической системы, тканевой гипоксии с выбросом недоокислен-ных веществ, лизосомальных энзимов.
Во всех этих случаях накапливающиеся токсичные вещества способствуют нарушению проницаемости клеточных мембран. По-розность эндотелия сосудов стимулирует выход из сосудистого русла в интерстиций не только жидкости, но и белка. Токсичный отек является основной причиной формирования респираторного дистресс-синдрома и поражений других жизненно важных органов, являясь основным механизмом танатогенеза.
В настоящее время не вызывает сомнений обоснованность проведения детоксикации при таких осложнениях. Тем не менее, сам 4'>акт их возникновения говорит об исходной несостоятельности систем защиты. Развитие эндотоксикоза в еще большей степени усугубляет этот “вторичный” иммунодефицит. Поэтому даже самая эффективная детоксикация при гемосорбции оставляет человека беззащитным перед изначальными возбудителями и активизирующейся по ходу болезни грибковой, вирусной и другой, даже условно патогенной, микрофлорой. Медикаментозная иммуностимуля-ция и квантовая терапия не способны быстро и качественно восстановить угнетенные механизмы иммунной защиты.
Плазмаферез в обычном понимании - “удаление плазмы” -невозможно выполнить вследствие глубокой гипопротеинемии (уровень общего белка 55-45 г/л), сопутствующей эндотоксикозу. При этом только плазмообмен с возмещением удаляемого объема (до 1-1,5 ОЦП) донорской плазмой в состоянии не только удалить циркулирующие токсичные вещества, но взамен плазмы с некомпетентными иммуноглобулинами и антителами, комплиментом и опсони-нами, ввести донорскую плазму со всеми полноценными компонентами гуморального иммунитета, которые сразу же поднимают общий защитный потенциал больных и способствуют более быстрому и стойкому выздоровлению.
Однако, сравнивая эффективность таких различных методов эфферентной терапии как гемосорбция и плазмаферез при критических состояниях, не следует излишне противопоставлять их. Каждый их них имеет свою “нишу” и показания.
В практической жизни, встречаясь с больным, находящимся в состоянии тяжелого эндотоксикоза, на первом этапе следует как можно раньше провести детоксикацию. Это наилучшим образом
достигается гемосорбцией. За это время мобилизуется необходимое количество донорской плазмы и на фоне некоторой стабилизации состояния проводится сеанс плазмообмена. Каждая из этих процедур сочетается с УФО или лазерным облучением и непрямым электрохимическим окислением крови. При необходимости такие комплексные сеансы плазмообмена могут повторяться неоднократно.
АКТУАЛЬНОСТЬ ИССЛЕДОВАНИЯ И ЛЕЧЕНИЯ БОЛЕВЫХ
СИНДРОМОВ. ОБЗОР МАТЕРИАЛОВ ПО ИЗУЧЕНИЮ БОЛИ
В.А. Волчков, В. И. Страшное
СПбГМУ имени академика И.П. Павлова
Боль в настоящее время остается серьезной клинической проблемой, требующей значительных усилий по улучшению качества и эффективности ее терапии. Боль является основным симптомом, вынуждающим людей обращаться за медицинской помощью. Согласно статистическим данным служб здравоохранения и ведущих специалистов по проблеме боли, хроническими болевыми синдромами, являющимися чаще следствием некупированного острого болевого синдрома, в США страдают около 20 млн. человек. Это ежегодно оборачивается высокотехнологичному американскому здравоохранению и страховым компаниям (непосредственные затраты на лечение пациентов, выплата пособий по нетрудоспособности, потери вследствие выключения членов общества из трудового процесса и т.д.) расходами в десятки миллионов долларов в год [Bonica, 1978; Berman, 1979; Woodside, 1988]- В Германии, по подсчетам доктора Юнгкома (1995), страдают хроническими болями около 7 млн. человек, соответственно экономические потери также велики. В репрезентативном исследовании населения Дании о наличии мышечных болей (ишемической, воспалительной природы и т.д.) сообщили 36,8% мужчин и 64% женщин. В аналогичном исследовании, выполненном в США, средняя частота мышечных болей составила 53%.
Сложнейшей задачей практического здравоохранения, как следствие сложности патофизиологических механизмов, так и распространенности данной патологии в обществе, остается лечение болей в спине (дорсалгий) - Л. Богачева и соавт. считают, что амбулаторная “клиника боли” является основным звеном в лечении и реабилитации пациентов с болевым синдромом в спине, так как только 4% больных данной категории нуждаются в стационарном консервативном лечении и не более 0,1% - хирургическом лечении. По данным D. Vaca (Испания), возможности хирургического лечения дорсалгий ограничены, дискэктомия далеко не всегда купирует болевой синдром, а от послеоперационного болевого синдрома страдает около 60% пациентов этой категории. Несмотря на возросший интерес к проблемам боли, аналгезии и достижения фундаментальных наук в исследовании болевых механизмов, качество послеоперационного обезболивания в ряде случаев остается неудовлетворительным. По данным V- Marlaecki (Бельгия), 50% оперированных пациентов страдают болями интенсивностью более 5 баллов по 10-балльной системе ВАШ. Особенно сложно достичь адекватной послеоперационной анальгезии у пациентов, перенесших операции на органах грудной клетки. Около 70% из их испытывают стойкие интенсивные послеоперационные боли. У 44% пациентов продолжительность болевого синдрома превышает 6 месяцев, из них 66% постоянно нуждаются в обезболивании. В 1-3% случаев боль может появиться повторно после некоторого безболевого периода. Если учесть, что в США за 1987 г. проведено около 25,6 млн. операций (более 1 операции на 10 человек), то подобная статистика свидетельствует о большом числе больных, которые потенциально могут страдать от послеоперационной боли. В акушерстве от 1/3 до 2/3 рожениц нуждаются в обезболивании родов [Овечкин А.М., Гнез-дилов А.В., 1998].
По данным ВОЗ, ежегодно в мире умирают свыше 4 млн. онкологических больных, не получивших адекватного обезболивания в последние недели жизни (R.Ruiz-Lopez, Испания). Столь неудовлетворительные результаты объяснялись недостаточным использованием обезболивающих средств и преувелргченным страхом развития наркомании у смертельно больных людей. В терминальной стадии заболевания от боли страдают от 55 до 95% всех онкологических больных (S.Grond, Германия). При этом боли средней интенсивности испытывают 40-50%, а очень сильные и невыносимые - 25-30% пациентов [Осипова Н.А., t998].
Вышеуказанные статистические данные говорят об актуальности дальнейшего изучения и лечения болевых синдромов. Потребности общества и понимание важности проблемы привели к тому, что в США, Канаде, Англии, Швейцарии, Швеции и других странах успешно функционируют “клиники боли”, службы острой боли, профильные противоболевые отделения в больницах и университетских клиниках. По данным К. Davis (США), результатом внедрения противоболевой терапии явилось снижение частоты развития интенсивной послеоперационной боли с 37 до 13%. Лечение и консультации в “клиниках боли” пациентов с болевыми синдромами позволяют оказывать значительно более эффективную и грамотно построенную специализированную помощь, существенно ускоряют получение положительного эффекта от лечения, позволяют заметно быстрее возвращать трудоспособность многим больным или социально адаптировать их. В итоге для общества экономятся значительные финансовые средства, не говоря уже о гуманной стороне дела - реальном облегчении тяжелых страданий людей. Кроме того, такая помощь во многих случаях избавляет пациентов от весьма значительных затрат на обычно многомесячное и нередко многолетнее малоэффективное лечение различными видами неадекватно подобранных болеутоляющих и седативных средств, приносящих часто больше вреда, чем пользы [Цибуляк В.Н. и соавт., 1998].
К сожалению, проблема болевых синдромов абсолютно игнорируется российскими страховыми компаниями и здравоохранением как несуществующая. В нашей стране все еще нет даже официальной статистики на этот счет. Вместе с тем совсем нетрудно подсчитать, исходя из пропорций населения в нынешней России и основных странах мира, что речь идет о миллионах наших соотечественников, страдающих от различных видов хронической, а также часто рецидивирующей острой боли (что фактически приравнивает ее к боли хронической). И эти больные в масштабах страны не имеют уже много лет по-настоящему специализированной эффективной помощи, которая могла бы существенно уменьшить их физические и моральные страдания, вернуть к полноценной жизни и труду очень многих из них.
ВИДЫ АНЕСТЕЗИОЛОГИЧЕСКОГО ОБЕСПЕЧЕНИЯ В
ОПЕРАТИВНОЙ УРОЛОГИИ
В. А. Волчков, С.Х. Аль-Шукри, В.А. Красногоров
СП6ГМУ имени академика И.П.Павлова
Проведен ретроспективный анализ 416 историй болезни за 1997 г. пациентов, оперированных в клинике урологии СП6ГМУ им. акад. И. II. Павлова.
Целью анализа явилось определение соотношений видов анестезиологического обеспечения в оперативной урологии за указанный период.
Все операции на почках и верхних отделах мочеточника выполнялись в условиях эндотрахеального наркоза закисью азота (или фторотана) с фракционным внутривенным введением фента-нила или кетамина, что составило 28,8% от общего числа проведенных анестезий- По половому признаку это были: мужчин - 44 и женщин - 76; средний возраст оперированных - 48,0±12,5 лет; средний расход кристаллоидных растворов на одну операцию составил 1353,0±387,9 мл; коллоидных - 496,3±237,1 мл; кровопоте-ря - 523,8±237,1 мл; длительность операции - 109±90 мин; длительность анестезии - 145±100 мин. В 8,3% случаев течение наркоза осложнилось интраоперационным кровотечением. К особенностям эндотрахеального наркоза при урологических хирургических вмешательствах относятся постуральные реакции кровообращения и дыхания в нефизиологических позициях на операционном столе (почечное положение). Укладка больного в почечное положение сопровождается перераспределением крови в нижележащие отделы тела. В сдавленной валиком половине грудной полости часть венозной крови шунтируется, не участвуя в газообмене [Зильбер А.П., 1984]. Исходя из этого, ИВЛ в почечном положении осуществляли в режиме умеренной гипервентиляции (МОД превышал рекомендуемые объемы примерно на 20-30%) с положительным давлением на вдохе (20 см вод-ст.) и пассивным выдохом; среднее значение систолического АД (за исключением пациентов с кровотечениями) интраоперационно составило 138,8±20,5 мм рт-ст., диастолического - 83,6±10,8 мм рт.ст., САД - 111,2±1,0 мм рт.ст.
В оперативной урологии традиционно широко используются методы регионарной анестезии. В нашем наблюдении они составили 36,1% от общего количества анестезиологических пособий. Значительное большинство пациентов данной группы составляли мужчины пожилого возраста - б4,6±7,5 года. На этапе предоперационной подготовки у 95% больных диагностированы различные сопутствующие заболевания, причем у 75% - имела место сочетанная патология нескольких органов и систем. При аденомэктомиях, уретеро-литотомиях в нижней трети мочеточника, гемикастрациях, диагностических и лечебных манипуляциях в малом тазу эпидуральная анестезия (ЭА) проводилась в 66,7% случаев. Для эпидурального введения преимущественно использовали 2% раствор лидокаина -в среднем 18,2±3,9 мл в комбинации с наркотическими анальгети-ками - морфином (5-7 мг) или фентанилом (50-100 мкг). Сочетан-ного применения препаратов было достаточно для операций продолжительностью от 1,5 до 3 часов. Интраоперационное систолическое АД было на уровне 133,0±18,3 мм рт. ст., диастолическое -78,0±10,8 мм рт. ст ; САД - 105,5±1,2 мм рт. ст., кровопотеря -496,7±254,2 мл; расход кристаллоидных растворов - 1342,3± 431,0 мл; коллоидных - 554,2±172,4 мл. Продленную ЭА использовали для послеоперационного обезболивания, а также при затянувшейся или повторной операции по поводу кровотечения из ложа предстательной железы или тампонады мочевого пузыря (в 13,3% случаев).
Спинномозговая анестезия (СМА) проводилась в 33,3% случаев. Использовались низкая или средняя спинальная блокада с применением 2% раствора лидокаина 4,4±0,8 мл и 0,005% раствора фентанила - 79,0±20,0 мкг. Во время операции систолическое АД составило 125,8±17,2 мм рт.ст.; диастолическое - 74,0±12,9 мм рт. ст.; САД - 99,0±1,2 мм рт.ст. Израсходовано кристаллоидных растворов на одну операцию 1359,1±344,8 мл; коллоидных - 510,0± 86,2 мл. Медикаментозный сон во время операций при применении регионарных методов обезболивания осуществляли внутривенным введением 5-15 мг реланиума (сибазона). Осложнений при проведении ЭА и СМА за отчетный период не выявлено.
Внутривенное обезболивание применялось в 35,1% случаев. При инструментальных исследованиях, болезненных манипуляциях, дистанционной ударно-волновой литотрипсии, кратковременных (до 60 минут) небольших оперативных вмешательствах, таких как варикоцеле, эпицистостомия, циркуляторное иссечение крайней плоти, цистолитотомия, трансу ретральная резекция аденомы предстательной железы и опухолей мочевого пузыря. При внутривенном наркозе преимущественно использовали нейролептаналы-езию, барбитураты, кетамин и диазепам по общепринятым схемам. В данной группе было 66 мужчин и 80 женщин, в среднем 47,0±12,9 лет. Во время операции систолическое АД в среднем составляло 137,5+ 12,9 мм рт.ст., диастолическое - 81,4±6,4 мм рт.ст., САД - 109,5± 1,5 мм рт.ст.; кровопотеря незначительная.
Таким образом, проведенный анализ показывает, что в оперативной урологии используется практически в равной степени все современные виды анестезии (рис.). Адекватное анестезиологическое обеспечение характеризуется стабильными показателями гемо-динамики и дыхания, контролируемой (не только анестезиологом) кровопотерей, умеренным расходом лекарственных средств и растворов.
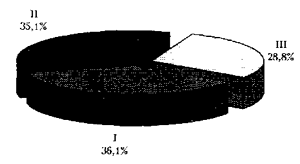
Рис. Соотношение видов анестезиологического обеспечения в оперативной урологии за 1997 г.: I - регионарные методы обезболивания; II - внутривенный наркоз; III - эндотрахеальный наркоз.
Министерство здравоохранения Российской Федерации. Санкт-Петербургский государственный медицинский университет имени академика И.II. Павлова. Актуальные проблемы анестезиологии, реаниматологии и интенсивной терапии. Материалы научной конференции. Под редакцией В.И. Cтрашнова.Санкт-Петербург, 2001, стр. 6 - 11






