ПАТОФИЗИОЛОГИЯ, НЕЙРОФИЗИОЛОГИЯ И НЕЙРОХИМИЯ БОЛИ
Тезисы Российской научно-практической конференции
"Патологическая боль", 14 - 16 октября 1999 г. (под ред. чл.-корр. РАМН Н.Н. Яхно,
д.м.н. М.Л. Кукушкина, к.м.н. С.С. Павленко), Новосибирск, - 1999 г.
Содержание раздела:
- Центральные механизмы патологической боли
Г. Н. Крыжановский - Патологическая боль: механизмы развития
М.Л. Кукушкин, В.К. Решетняк - Сравнительная оценка динамического процесса импульсной активности нейронов у крыс с развившимся и неразвившимся болевым синдромом
В Н Черкашенко, М.Л. Кукушкин, В. С. Смирнова - О метаболической регуляции функции нейрональных мембран
С.Н.Айрапетян - Анализ центральных механизмов афферентации в условиях ноцицепции и антиноцицепции
Е Е.Мейзеров - Экспериментальные модели тактильной аллодинии
С.И.Игонькина Институт общей патологии и патофизиологии РАМН, г.Москва - Особенности модификации детерминантных структур патологических алгических систем в процессе купирования миофасциального болевого синдрома
А.В. Овчинников - Ноцицептивные рефлекторные ответы т.тнеnаr при болевой электрической стимуляции указательного пальца у человека
А.В.Сыровегин, МЛ.Кукушкин, А.В.Гнездшюв, А.М.Овечкин, Т.С. Ли - Межсегментарные ноцицептивные эмг - реакции скелетных мышц при болевой электрической стимуляции у человека
А.В.Сыровегин, М.Л.Кукушкин, А.В.Гнездилов, А.М.Овечкин, Т.С.Ли - Характеристика r2 компонента мигательного рефлекса при хронической вертеброгенной боли
Р.А.Якупов - Мигательный рефлекс при мигрени
Т.А.Филиппова, А.Б.Данилов, А.М.Вейн - Изменения ээг при болевом синдроме
Н.А.Красноярова, И.М.Кальменева, Н.К.Клштцкая - Влияние ненаркотических анальгетиков на механизмы нисходящего кортикального контроля ноцицептивных сигналов
В.В. Чурюканов - Изменения содержания биогенных аминов в различных отделах мозга в инициальном периоде формирования острой соматической боли
А.Е.Шумарип, В.Г.Овсянников - Серотонин и гистаминергические механизмы мозга в инициальном периоде острой соматической боли
В.Г. Овсянников, А. Е. Шумарин - Некоторые вопросы метаболизма эндогенных опиатов при острой болевой травме и электроакупунктуре
Л.А.Назырова, И.Ю.Шумилова - Состояние нитрооксидергических структур при острой боли
В.Б.Шуматов, Т В.Балашова, Т.А.Шулштова - Нитрооксидсинтазные механизмы антиноцицептивного эффекта морфина
В.Б.Шуматов, Т.А.Шуматова, Т.В.Балашова - Спектральный анализ дозозависимого влияния морфина на биоритмы болевой чувствительности мышей
А.Н. Кубынин - Исследование механизма действия агониста к-опиатных рецепторов u-50488 на тромбоциты
И.В.Миндукшев, М.Р.Сакаев, Ю.Д.Игнатов, Н.Н.Петрищев - Экспериментальное изучение механизмов действия допаминергических препаратов при мигрени
А.В.Амелин, К.Д. Игнатов, В.Е. Иванов - Влияние баклофена на роль левого и правого полушарий головного мозга в регуляции болевой чувствительности и аналгезии у мышей
В. В..Михеев - Оценка состояния соматосенсороной афферентации у подростков с болевой диабетической полиневропатией
Е.И.Карпович, А.В.Густое, Е. Ф.Лукушкина - Диабетическая полинейропатия - клинико-электрофизиологические сопоставления
П.И. Пилипенко, Е.В. Вострикова - Влияние неспецифической противовоспалительной терапии на катехоламиновый обмен у мужчин и женщин при хронической боли нейропатического генеза
В.Г.Овсянников, И.М.Котиева - Половые особенности моноаминового обмена у мужчин и женщин
И.М.Катаева - Нейроиммунология боли
A.M. Василенко
Центральные механизмы патологической боли
Г. Н. Крыжановский
НИИ обшей патологии и патофизиологии РАМН, г.Москва
В отличие от физиологической боли, имеющей сигнальное значе-ние и активирующей биологические и поведенческие механизмы устранения алгогенного фактора, патологическая боль играет патоген-ную роль, она нарушает адаптивные механизмы и вызывает расстрой-ства деятельности ЦНС и внутренних органов. Патологическая боль отличается также от физиологической боли механизмами осуществ-ления и клинико-поведенческими проявлениями. Важными патофи-зиологическими механизмами патологической боли являются обра-зование и деятельность генераторов патологически усиленного воз-буждения в системе болевой чувствительности. Под влиянием гене-ратора формируется новая патодинамическая организация - патологическая алгическая система (ПАС), лежащая в основе болевого син-дрома. Патогенетическая структура ПАС, т.е. то, какие отделы систе-мы болевой чувствительности составляют ПАС, определяет характер и клиническое выражение патологической боли. Течение присту-па боли зависит от особенностей активации ПАС. Каждый болевой синдром имеет свою ПАС. Создавая генератор в определенных, патогенетически значимых для того или иного болевого синдрома отде-лах системы болевой чувствительности, можно вызвать в экспери-менте соответствующие болевые синдромы (например, болевой син-дром спинального происхождения, тригеминальную невралгию, таламический болевой синдром и др.). Стечением времени ПАС зак-репляется пластическими процессами, ее резистентность к есте-ственным контролирующим влияниям и лечебным воздействиям возрастает.
Патологическая боль: механизмы развития
М.Л. Кукушкин, В.К. Решетняк
НИИ общей патологии и патофизиологии РАМН, г.Москва
На основании клинико-экспериментальных данных об этиопато-генезе патологической боли, все болевые синдромы подразделяют-ся на три основные группы: соматогенные, нейрогенные и психоген-ные. Патофизиологической основой соматогенных болевых синдромов является сенситизация ноцицепторов и центральных ноцицептивных нейронов, что приводит к развитию первичной и вторичной гиперал-гезии. Первичная гипералгезия охватывает участки поврежденной ткани, вторичная гипералгезия определяется за пределами зоны по-вреждения. В механизмах сенситизации ноцицепторов ведущая роль принадлежит медиаторам воспаления (брадикинину, метаболитам арахидоновой кислоты, биогенным аминам), накапливающимся в зоне повреждения. Гиперактивация ноцицептивных нейронов опосредуется возбуждающими аминокислотами (аспартат и глутамат) через Г4МОА-рецепторы и нейропептидами С-афферентов (субстанция Р, нейро-кинин А), которые высвобождаются из пресинаптических термина-леи при повреждающем воздействии. Наряду с сенситизацией ноци-цептивных нейронов дорзальных рогов спинного мозга, повреждение тканей вызывает патологическую гиперактивность нейронов и в вы-шележащих ноцицептивных центрах, включая ядра таламуса и со-матосенсорную кору больших полушарий.
Механизмы возникновения нейрогенных болевых синдромов в кор-не отличаются от болевых синдромов, вызванных повреждением со-матических тканей или внутренних органов. Развитие нейрогенных болевых синдромов в настоящее время связывают с морфофункци-ональными изменениями как в периферическом травмированном не-рве, так и в центральной нервной системе.
Структурной основой нейрогенных болевых синдромов, согласно представлениям Г.Н. Крыжановского (1980,1997), является агрегат взаимодействующих сенситизированных нейронов с нарушенными тормозными механизмами и повышенной возбудимостью. Такие агрегаты способны развивать длительную самоподдерживающуюся патологическую активность, для которой не обязательна афферентная стимуляция с периферии. Формирование агрегатов гиперактивных нейронов осуществляется синаптическими и несинаптическими механизмами. Одним из условий образования агрегатов при повреж-дении нейрональных структур является возникновение устойчивой деполяризации нейронов, которая обусловлена:
а) выделением возбуждающих аминокислот, нейрокининов и оксида азота;
б) дегенерацией первичных терминален и транссинаптической гибелью нейронов дорзального рога с
последующим их замещением глиальными клетками;
в) дефицитом опиоидных рецепторов и их лигандов, контролирующих возбуждение ноцицептивных клеток;
г) повышением чув-ствительности тахикининовых рецепторов к своим лигандам - субстанции Р и нейрокинину
А.
Важное значение в механизмах образования агрегатов гиперактивных нейронов в структурах ЦНС отводится подавлению тормозных реакций, которые опосредуются глицином и гаммааминомасляной кислотой (ГАМК). В условиях недостаточности тормозных механизмов и повышенной возбудимости нейронов облегчаются синаптические межнейронные взаимодействия, происходит активация "молчащих" неактивных синапсов и объединение близлежащих сенситизированных нейронов в единый агрегат.
При формировании нейрогенных болевых синдромов глубокие нейропластические преобразования затрагивают не только первичное ноцицептивное реле, но и высшие структуры системы болевой чувствительности.
Ведущее значение в механизме развития психогенных болевых синдромов отводится психологическим факторам, которые иниции-руют боль при отсутствии каких-либо серьезных соматических рас-Ятоойств Часто боли психологической природы возникают вследствие перенапряжения каких-либо мышц при эмоциональных переживани-ях Психогенная боль может являться составной частью истеричес-кой реакции или депрессии, возникать как бред или галлюцинация при шизофрении и исчезать при адекватном лечении основного за-болевания.
Сравнительная оценка динамического процесса импульсной активности нейронов у крыс с развившимся и неразвившимся болевым синдромом
В Н Черкашенко, М.Л. Кукушкин, В. С. Смирнова
НИИ общей патологии и патофизиологии РАМП, г.Москва
Согласно концепции Г.Н.Крыжановского (1980,1997), патофизиологической основой нейрогенных болевых синдромов является генератор патологически усиленного возбуждения (ГПУВ), представляющий собой агрегат сенситизированных взаимодействующих нейронов с самоподдерживающейся активностью. Для проверки высказанных положений в настоящей работе изучалирсобенности динамического процесса импульсной активности нейронов дорзальных рогов спинного мозга у крыс с развившимся и неразвившимся после перерезки седалищного нерва болевым синдромом.
Для этого в работе использовались следующие методы анализа временных рядов импульсной активности
нейронов: восстановление функции плотности вероятности межспайковых интервалов; восстановление
спектральной плотности межспайковых интервалов; обнаружение хаотической динамики в рядах межспайковых
интервалов. Для обнаружения хаотической динамики использовались следующие, вычисляемые по зарегистрированным
временным рядам характеристики - фрактальная размерность; корреляционный интеграл и корреляционная
размерность; экспаненты Ляпунова; размерность вложенного пространства; картина восстановленного
аттрактора; последовательность Пуанкаре; бифуркационные диаграммы.
Произведенный нами анализ показал, что у интактных животных и крыс с неразвившимся болевым синдромом
плотности вероятности имели вид в "экспоненциальных" затухающих функции, что характерно
для пуассоновских или виннеровских процессов. При сравнении функций спектральной плотности у животных
с болевым синдромом на спектрах обнаруживались четко выраженные пики в ряде спектральных областей.
В то время как на спектрах интактных жи-вотных или крыс с неразвившимся болевым синдромом ярко
выра-женных спектральных пиков обнаружено не было. Одновременно у этих животных на спектральных
кривых отмечалась зависимость типа 1/т, что характерно для процессов, обладающих хаотической компо-нентой.
Кроме этого, интактные животные и крысы с неразвившимся болевым синдромом характеризовались более
высокой корреляци-онной размерностью, значение которой было дробным. У животных с болевым синдромом
значение вложенной размерности было мень-ше и целочисленно. Сравнение в фазовом пространстве аттракторов
для интактных животных и крыс с болевым синдромом выявило большую топологическою сложность последних
для интактных крыс, тогда как у животных с болевым синдромом наблюдалась достаточно четкая картина
многомерного тора, на которой накручивались фазо-вые траектории.
Таким образом, на основании проведенных исследований можно сделать вывод о том, что импульсная активность нейронов живот-ных с болевым синдромом становится похожей на работу метронома и характеризуется меньшим количеством степеней свободы и большей "зарегулированностью". Это проявляется в обеднении геомет-рии притягивающего множества в фазовом пространстве и в появле-нии, вместо шумоподобного, спектра с четко выраженными пиками. "Зарегулированность" также находит отражение в переходе стран-ного аттрактора в многомерный тор, с "накрученными" на него тра-екториями. Упрощение спектральной картины импульсной активно-сти нейронов у животных с болевым синдромом отражает снижение "внешних" регуляторных влияний на пул нейронов и согласуется с представлениями Г.Н.Крыжановского о генераторных механизмах развития нейропатологических синдромов.
О метаболической регуляции функции нейрональных мембран
С.Н.Айрапетян
Центр Биофизики НАН Армении, г. Ереван
Ранее было показано, что белковые молекулы на клеточной мем-бране могут быть в функционально активном и пассивном состояни-ях, количественное соотношение которых варьирует в зависимости от изменений величины мембранной поверхности . Набухание клеток приводит к увеличению, а сморщивание - к умень-шению количества функционально активных молекул. Было предпо-ложено, что чрезмерное повышение гидратации приведет к чрезмер-ному увеличению электрической активности. Кле-точная гидратация, возможно, служит неким вторичным мессендже-ром для реализации воздействий внутренних и внешних болевых раз-дражителей Nа-К помпа и Nа.Са обмен являются основными механизмами посредством которых осуществляется метаболическая регуляция клеточной гидратации. При патологии в первую очередь нарушается работа Nа-К помпы, активируется работа Nа.Са обменни-ка КОТОРЫЙ Является универсальным сверхчувствительным сенсором сверхслабых химических,физических и метаболическихфакторов. Тесная кореляция двух систем осуществляется посредством системы внутриклеточных циклических нуклеотидов, что позволяет включить что Nа-К помпа и NaСа обмен являются основными мембранными механизмами метаболической регуляции функции неиро-нальной мембраны. Стр.3
Анализ центральных механизмов афферентации в условиях ноцицепции и антиноцицепции
Е Е.Мейзеров
Научно-практический центр традиционной медицины и
гомеопатии МЗ РФ, г. Москва
Наряду с применением современных вариантов медикаментоз-ной терапии острых и хронических болевых
синдромов большое вни-мание уделяется разработке немедикаментозных методов. Однако, несмотря на
успехи в практическом применении различных методов борьбы с болью, целый ряд вопросов, связанных
с регуляцией ноци-цептивных и антиноцицептивных систем мозга при обезболивании остается недостаточно
изученным. Это, в первую очередь, касается вопросов о механизмах центрального действия наркотических
аналь-гетиков и акупунктуры, об особенностях их влияния на специфичес-кие и неспецифические пути
сенсорного проведения.
В клинико-физиологических исследованиях на основании анали-за данных по динамике изменений ранних
и поздних компонентов разномодальных вызванных потенциалов установлено, что анальге-тики центрального
действия из группы агонистов и агонист-антагони-стов опиатных рецепторов оказывают не одинаковое
влияние на про-ведение в афферентных системах мозга человека. Обнаружено, что действие различных
препаратов связано не только с тормозным, но и с возбуждающим влиянием на структуры мозга. В другой
серии ис-следований получены данные о влиянии электро-стимуляционных способов рефлекторного воздействия
на передачу афферентных сиг-налов в специфических и неспецифических системах мозга челове-ка.
При оценке эффективности низко- и высокочастотной электро-стимуляции в точках акупунктуры локально-сегментарного
и обще-анальгетического действия установлена зависимость выраженности аналгезии от параметров
и локализации воздействия. Результаты проведенных исследований позволили расширить и конкретизиро-вать
научные представления об особенностях афферентного прове-дения в специфических и неспецифических
системах мозга челове-ка в условиях ноцицепции, медикаментозной и рефлекторной анал-гезии. Стр.4
Экспериментальные модели тактильной аллодинии
С.И.Игонькина Институт общей патологии и патофизиологии РАМН, г.Москва
Термином аллодиния обозначен феномен возникновения болево-го ощущения при раздражении поверхности тела неболевыми стиму-лами. Аллодиния является характерным признаком тяжелых нейро-генных болевых синдромов. Цель работы - разработка моделей ал-лодинии. Теоретическими предпосылками для моделирования алло-динии явились положения концепции генераторных и системных ме-ханизмов центральных болевых синдромов (Крыжановский Г.Н.). Мо-делирование проводили на крысах путем нарушения тормозных ме-ханизмов в ключевых структурах ноцицептивной системы. Для про-странственно-временной оценки возникновения и локализации зон аллодинии у экспериментальных животных разработана батарея по-веденческих тестов на механические и термические воздействия. Получены модели тактильной аллодинии путем нарушения тормоз-ных механизмов в дорсальных рогах люмбального отдела спинного мозга с помощью аппликации конвульсантов (пенициллина и столб-нячного токсина). Зоны аллодинии топографически соответствовали сегменгтам спинного мозга с нарушенными тормозными связями. Клинические проявления тактильной аллодинии выявлены у крыс с тригеминальной невралгией, вызванной микроинъекцией конвульсан-тов в каудальное ядро тройничного нерва. Разработана также модель аллодинии с помощью аппликации антител к нейромедиатору серо-тонину на дорсальные рога спинного мозга. Для каждой модели свой-ственны свои пространственно-временные характеристики. Получе-ные модели тактильной аллодинии могут быть использованы как для изучения базисных механизмов патологической боли, так и для раз-работки новых подходов к терапии нейрогенной боли. Стр.6
Особенности модификации детерминантных структур патологических алгических систем в процессе купирования миофасциального болевого синдрома
А.В. Овчинников
Казанская Государственная медицинская академия, г.Казань
Проведен сравнительный анализ ранних, промежуточных и поз-дних компонентов соматосенсорных вызванных
потенциалов для изу-чения влияния хронического болевого синдрома и его купирования на латентность
и амплитуду вызванных потенциалов (ВП) у больных с миофасциальными болями в области плечевого
пояса в аспекте анализа динамики формирования и распада детерминант, первич-ных и вторичных (Крыжановский
Г.Н.,1997), до и после лечения, их миграции в пределах формируемой ими патологической алгической
системы (ПАС).
Проводилась гомолатеральная электрическая стимуляция средин-ного нерва в области кисти и регистрация
ВП в контралатеральной области в точке соматосенсорной проекции стимулируемой кисти при гомо-
и контрапатеральном миофасциальном болевом синдроме.
До лечения в модели "гомолатеральный стимул-томолатераль-ная ПАС- гомолатеральная боль"
выявляются детерминанты с пол-ной реализацией (укорочение латентности и увеличение амплитуды компонента
ВП с Р<0.001) на подкорковом и корковом уровнях. Пос-ле лечения в соответствующих зонах сохраняются
детерминанты с менее выраженной синхронизацией (удлинение латентности) и сме-щенные каудально
(например, НЗ вместо Н4). Кроме того, выявля-ются детерминанты с неполной реализацией в виде снижения
амп-литуд, которые были подавлены доминирующим очагом активности. Данный характер изменений объясняется
тем, что гомолатеральная стимуляция гомолатеральной ПАС способствует ее большей актива-ции, поэтому
в данном случае активность изолированных генерато-ров патологически усиленного возбуждения (ГПУВ)
при активности основной детерминанты не выявляется.
В модели "гомолатеральный стимул-контралатеральная ПАС-контралатеральная боль" восходящая
сенсорная посылка активиру-ет коллатерально изолированные ГПУВ, проявляющиеся после лече-ния,
то есть они "зеркальны" тем генераторам в модели "гомолате-ральный стимул-гомолатеральная
ПАС-гомолатеральная боль", ко-торые не проявляются при гомолатеральной стимуляции, но способ-ствуют
их выявлению. При этом уже ставшая латентной контралате-ральная детерминанта не способна подчинить
своему ритму эти ге-нераторы, вероятно, за счет активации антиноцицептивной системы.
Таким образом, после лечения детерминанта, как правило, уже латентная, смещается каудально, то
есть происходит ее миграция к области ранее существовавшей первичной детерминанты с полной реализацией.
Обе модели стимуляции и регистрации ВП примени-мы до и после лечения для оценки изменений первичных
и сопут-ствующих им вторичных детерминант. Модель "гомолатеральный стимул-контралатеральная
ПАС-контралатеральная боль" может специально применяться для выявления изолированных ГПУВ,
не входящих в ПАС. Стр.7
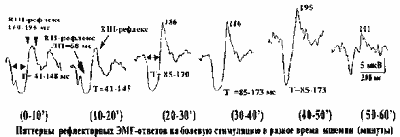
Ноцицептивные рефлекторные ответы т.тнеnаr при болевой электрической стимуляции указательного пальца у человека
А.В.Сыровегин, МЛ.Кукушкин, А.В.Гнездшюв, А.М.Овечкин, Т.С. Ли
НИИ общей патологии и патофизиологии РАМП, Москва Центральный НИИ протезирования и протеюстроения,
г. Москва
ЭМГ-реакции мышц предплечья и плеча, вызванные болевой элек-тростимуляцией пальцев руки у человека,
были описаны ранее (Гнез-диловидр.,1998). Более устойчиво они возникают в т.Шепаг. Зада-ча настоящей
работы состояла в попытке выяснения природы реф-лекторных ЭМГ-реакций т.Ипепаг, вызванных болевой
стимуляцией указательного пальца в обычных условиях и во время функциональ-ной ишемии раздражаемого
пальца.
В исследованиях участвовало 6 добровольцев-мужчин без сома-тических нарушений. Болевое раздражение
наносили на 2-ю и 3-ю фаланги указательного пальца одиночными электрическими импуль-сами прямоугольной
формы, длительностью 0.2 мс, частотой 0.5 Гц и силой порядка 40 мА. ЭМГ т.Шепаг отводили биполярно
поверхно-стными электродами во время слабого тонического приведения боль-шого пальца и регистрировали
на физиологической системе Т1Е8У-VIII, методом компьютерного усреднения по модулю (частота опроса
0.8 мс, 200 усреднений). Записи проводили до начала и в течение 1 часа функциональной деафферентации
указательного пальца, осу-ществляемой с помощью жгутирования проксимальной фаланги.
Болевая стимуляция вызывает в тонической ЭМГ тЛМепаг пери-оды торможения и повышенной активности,
которые при усредне-нии представляют собой сложный паттерн ЭМГ-ответа: начальное короткое торможение
(Л П=41 мс), затем слабое повышение разря-довой активности, названное КП-рефлексом (ЛП=66 мс),
далее воз-никало мощное длительное торможение (Т=85-145 мс) с последую-щим повышением активности,
обозначенным, как КШ-рефлекс Пиковые латентности КШ-рефлекса даны цифрами вверху записей в мс,
ниже -суммарный временной диапазон 2-х торможений (Т) для 1-й и 2-й записей.
После 20 минут действия жгута, в паттерне комплексного реф-лекторного ЭМГ-ответа исчезали ранний
период торможения (ЛП=35 мс) и РчИ-рефлекс. К 30-й минуте терялась тактильная и проприо-цептивная
чувствительность, вместе с появлением деафферентаци-онной боли, усилением позднего торможения
и (ЧШ-рефлекса. Пос-ледние продолжали усиливаться до 50-й минуты жгутирования и резко уменьшались
к 60-й минуте ишемии с грубым снижением ощущения-боли. Предполагается, что компонент позднего
торможения (Т=85-173) и Rill-рефлекс в паттерне ЭМГ ответа m.thenar на болевую стиму-ляцию отражают
рефлекторную болевую реакцию на активацию но-цицептивных А5 афферентных волокон, тогда как начальное
тормо-жение (Т=41) и Rll-ответ образуются в результате возбуждения аф-ферентов группы Ib от органов
Гольджи и чувствительных быстро-проводящих кожных Ар афферентов. Стр.9
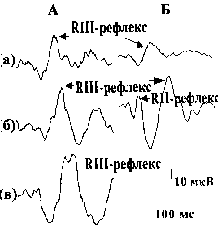
Межсегментарные ноцицептивные эмг - реакции скелетных мышц при болевой электрической стимуляции у человека
А.В.Сыровегин, М.Л.Кукушкин, А.В.Гнездилов, А.М.Овечкин, Т.С.Ли
НИИ общей патологии и патофизиологии РАМН, Москва
Центральный НИИ протезирования и протезостроения, г.Москва
Ноцицептивный Rill-рефлекс (Hugon,1973), регистрируемый с мышц-сгибателей ноги на электростимуляцию
n.suralis или дермато-мы стопы, сейчас широко применяется в клинических исследовани-ях. Нами приводятся
факты возможности вызова Rill-рефлекса и в мышцах руки при раздражении пальца. Хотя очевидно,
что его воз-никновение связано с активацией А5 афферентных волокон одного или 2-х смежных сегментов,
остаются неясными центральные меха-низмы формирования Rlll-рефлексаучеловека. Задача исследова-ний
состояла в том, чтобы проследить возможность и особенности образования Rill-рефлекса m.tibialis
anterior и m.thenar при болевой электрической стимуляции разных участков кожи на теле человека,
далеко разнесенных друг от друга по уровням сегментов.
В исследованиях участвовало 6 здоровых добровольцев-мужчин. Для болевого воздействия использовали
одиночные электрические импульсы прямоугольной формы, длительностью 0.2 мс, частотой 0.5 Гц и
силой порядка 40-50 мА, которые отдельно наносили на: (а) мочку уха; (б) фаланги указательного
пальца руки; (в) фаланги 1 -го -2-го пальца стопы. Ипсилатеральные ЭМГ m.tibialis anterior(A)
и m.thenar(B) отводили биполярно поверхностными электродами во время слабого тонического тыльного
сгибания стопы или приведе-ния большого пальца, соответственно. ЭМГ активность регистриро-вали
на физиологической системе TIESY-VIII, методом компьютер-ного усреднения по модулю (частота опроса
0.8 мс, количество ус-реднений -150-200). anterior и m.thenar возникает как при стимуляции дерматомы
од-ного и того же сегмента, так и при раздражении далеко отнесенных участков кожи. Началу Rill-рефлекса
всегда предшествует период тор-можения. Латентности торможения и RIII- рефлекса укорачиваются
соответственно уменьшению длины между местом болевого воздей-ствия и местом отведения.
Если пиковая латентность Rill-рефлекса при стимуля-ции пальцев стопы состав-ляла 218-255 мс, то
при раз-дражении мочки уха она была 130-140 мс. Пиковые латентности периодов тор-можения соответственно
со-ставили 84-90 и 132-153 мс. Чем больше расстояние между сегментами участка болевого раздражения
и ме-стом отведения, тем слабее период торможения и мень-ше величина Rill-рефлекса. Полученные
данные позво-ляют заключить: 1 - период торможения, предшествующий Rill-рефлексу, является тормозной
ноцицептивной реакци-ей двигательных центров спинного мозга на активацию А8аф-ферентов; 2 - Rill-рефлекс
и предваряющее торможение образу-ются не только или не столько на уровне спинного мозга, но и
вовлекают в свое формирование надсегментарные ноцицептив-ные образования, организующие свое влияние
по типу long-loop рефлекса (Eccles,1966) или спино-бульбо-спинального рефлекса (Shimamura,Aoki,1969).
Стр.11
Характеристика r2 компонента мигательного рефлекса при хронической вертеброгенной боли
Р.А.Якупов
Казанская государственная медицинская академия, г.Казань
Данные об участии различных отделов сенсомоторной системы в реализации мигательного рефлекса
(МР) определяют широкое ис-пользование данного теста в современных исследованиях (Esteban А.А.,
1999). Вместе с тем недостаточно изученными остаются изме-нения R2 компонента МР при хроническом
болевом синдроме вер-теброгенной этиологии.
Цель работы. Оценка информативности электронейрофизиоло-гических характеристик R2 компонента МР
при хронической вертеб-рогеннойболи.
Материал и методы. Было обследованно 64 больных с вертеб-рогенными радикулопатиями Ls,Si,Ls и
Si, которые по результатам мониторингового 6 месячного наблюдения были подразделены на две группы:
"А" (30 чел.)-благоприятное течение и "Б" (34 чел.)-небла-гоприятные (затяжное)
течение болевого синдрома. Всем больным проводилось неврологическое обследование, тестирование
по визу-ально-аналоговой шкале боли, MMPI, электронейромиографическое исследование МР по стандартной
методике (Бадалян И.О., Сквор-цов И.А., 1986). Контрольная группа включала 30 здоровых испытуе-мых.
Результаты. Установленно достоверное уменьшение латентно-сти R2 компонента МР в гр. "Б"
по сравнению с гр. "А" (соответ-ственно 33,41 ±0,32 мс и 37,36±0,59 мс р<0,001) и
контролем (33,41±0,32 мс и 37,36±0,59 мс р<0,001). Длительность R2 компо-нента МР была достоверно
увеличена в гр. "Б" по сравнению с гр "А" (49,16±0,59мс и 36,06+1,04 мср<0,001)
и контролем (49,16±0,59 мси 35,01 ±0,56 мср<0,001). В группе "Б" выявлены достоверные
корреляционные зависимости между субъективной выраженностью боли поданным визуально-аналоговой
шкалы и показателями МР, в частности, прямая связь с длительностью R2, обратная - с латент-ным
периодом и порогом R2.
Заключение. Полученные результаты свидетельствуют о повыше-нии рефлекторной возбудимости сегментарных
и супрасегментарных структур ствола головного мозга у больных с затяжным течением вер-теброгенного
болевого синдрома, что объективно характеризует осо-бенности реактивности ЦНС у больных с хронической
болью.
Следует подчеркнуть актуальность использования параметров R2 компонента МР в качестве теста функциональной
диагностики при хронической вертеброгенной боли. Стр.12
Мигательный рефлекс при мигрени
Т.А.Филиппова, А.Б.Данилов, А.М.Вейн
Отдел патологии вегетативной нервной системы ММА им. ИМ. Сеченова, г. Москва.
Согласно современным представлениям о патогенезе мигрени, бо-левой синдром при этом заболевании
развивается вследствие ней-рогенного асептического воспаления как результата эфферентной активности
периваскулярных сенсорных волокон, принадлежащих первой ветви тройничного нерва.
Целью настоящей работы явилось изучение функционального со-стояния тригеминальной системы (ТС)
при мигрени
Материалы и методы. Мигательный рефлекс (МР) исследовал-
ся по стандартной методике: одиночные прямоугольные импульсы длительностью 2 мс наносились в проекции
точки выхода п зиргаогЬКаНз, регистрация биоэлектрической активности т. огЫсЫапз осиН осуществлялась
с помощью поверхностных биполярных элект-родов. Оценивались пороги компонентов МР, их латентные
периоды (ЛП) и габитуация позднего компонента К2. Обследовано 18 боль-ных с латерализованной мигренью
(группы сравнения: 15 здоровых испытуемых и 8 пациентов с головными болями напряжения). Ос-новная
группа включала 2 подгруппы: больные, которым исследова-ние проводилось в первые 5 дней после
приступа и перед присту-пом.
Результаты: 1. При исследовании МР отличий в ЛП раннего и позднего компонентов у больных мигренью
выявлено не было;
2. В группе больных мигренью обнаружено достоверное снижение порогов К2 с двух сторон, в большей
степени на преимущественной стороне головной боли и перед приступом;
3. У больных мигренью выявлено снижение габитуации позднего К*, компонента МР.
Выводы: Снижение габитуации позднего компонента МР, а также снижение порога К2 у больных мигренью
в межприступном периоде может свидетельствовать о гиперактивности стволовых аппаратов тригеминальной
системы.;
Асимметрия порогов Р2 (более низкие значения на стороне це-фалгии) может указывать на роль тригеминальной
системы в выбо-ре стороны головной боли;
Изменение порогов Р2 до и после приступа отражают динамич-ный характер гиперактивации ТС в цикле
до и после приступа, что соотносится с данными, полученными при исследовании тригеми-нальных ВП
и СМУ. Стр.13
Изменения ээг при болевом синдроме
Н.А.Красноярова, И.М.Кальменева, Н.К.Клштцкая Алматинскип нститут усовершенствования врачей, Казахский государственный медицинский университет имени С.Д. Асфендиярова, г.Алматы
Одним из ведущих симптомов при заболеваниях нервной систе-мы является боль, важное значение
в формировании которой имеют супраспинальные структуры, относящиеся к головному мозгу. С це-лью
объективизации болевого синдрома и уточнения локализации его формирования по биоэлектрической
характеристике проведены ЭЭГ-исследования.
Среди заболеваний нервной системы первое место по обращае-мости занимают заболевания периферической
нервной системы, бо-левой синдром при которых нередко приводит к стойкой инвалидно-сти. Сосудистые
заболевания нервной системы являются актуаль-
ной проблемой клинической медицины, что объясняется их широкой распространенностью и высокой смертностью.
При начальных про-явлениях недостаточности кровоснабжения мозга одним из ведущих симптомов является
головная боль.
115 больным с рефлекторными и корешковыми синдромами по-ясничного остеохондроза, 25 больным с
рефлекторными синдрома-ми шейного остеохондроза, 95 больным с начальными проявления-ми недостаточности
кровоснабжения мозга проведено ЭЭГ-исследо-вание. У всех больных в клинической картине ведущим
проявлением заболевания являлся болевой синдром.
Анализ ЭЭГ позволил выявить нерегулярный и низкоамплитуд-ный альфа-ритм. Высокочастотная бета-активность
регистрирова-лась в лобно-центральных отделах с двух сторон и была представ-лена нерегулярными
колебаниями. Довольно часто отмечались мед-ленные тэта-волны низкой амплитуды, рассеянные асинхронные
ко-лебания разной частоты, заостренные волны. В некоторых случаях проявлялась пароксизмальная
активность, которая была представ-лена волнами тэта- и дельта-диапазона.
Следовательно, на ЭЭГ регистрировалась преимущественно диф-фузная дизритмия, десин-хронизация,
иногда - гиперсинхронизация ритмов. Изменения ЭЭГ при болевом синдроме свидетельствовали о функциональном
нарушении деятельности срединных структур го-ловного мозга и позволяли объективно оценить болевой
синдром. Стр.14
Влияние ненаркотических анальгетиков на механизмы нисходящего кортикального контроля ноцицептивных сигналов
В.В. Чурюканов
Московская медицинская академия им. И.М.Сеченова, г.Москва
Клинические наблюдения и экспериментальные данные свиде-тельствуют о том, что кора большого
мозга (КБМ) играет существен-ную роль в восприятии и регулировании боли. Одним из возможных механизмов
действия болеутоляющих средств может быть усиление нисходящих тормозных кортикальных влияний на
передачу ноцицеп-тивных импульсов в афферентных путях.
_В острых опытах на кошках в условиях общей анестезии хлорало-зой регистрировали активность нейронов
заднего рога спинного моз-га и ядер тригеминапьного комплекса (преимущественно мультире-цептивные
нейроны), возникающую при электрической стимуляции афферентных нервов задней конечности или пульпы
зуба (тестиру-ющее ноцицептивное раздражение). Кондиционирующей стимуляции подвергали кору большого
мозга (1 -я и 2-я зоны соматовисцераль-ной чувствительности, фронто-орбитальная область). Для
сравне-ния раздражали структуры околоводопроводного серого вещества и
ядра шва. Установлено, что анальгин (20-60 мг/кг в вену) усиливает на 10-30% угнетающий эффект
кортикальной стимуляции у 2/3 ис-следованных нейронов. В использованных дозах анальгин не оказы-вает
непосредственного влияния на спонтанную и вызванную актив-ность отдельных нейронов. Налоксон не
снимал эффект анальгина. Кеторолак (1 -5 мг/кг в вену) оказывал сходное с анальгином действие,
однако в отношении меньшего количества нейронов. Парацетамол в дозах до 100 мг/кг не оказывал
влияния на эффекты электрической стимуляции КБМ. Стр.15
Изменения содержания биогенных аминов в различных отделах мозга в инициальном периоде формирования острой соматической боли
А.Е.Шумарип, В.Г.Овсянников
Ростовский государственный медицинский университет, г. Ростов-на-Дону
В острых опытах на крысах-самцах линии Вистар моделировали острую соматическую боль путем электрораздражения
кожи задней конечности животного в течение 10-15 сек. Методом флюорометрии определял и содержание
биогенных аминов-адреналина (А), норад-реналина (НА) и дофамина (ДА) в спинном мозге, а также
в структу-рах головного мозга: соматосенсорной коре, гипоталамусе, таламу-се, гиппокампе и ретикулярной
формации среднего мозга в иници-альном периоде формирования острой соматической боли.
Установлено, что изменения количества А во всех изучаемых струк-турах мозга имеет однонаправленный
характер и проявляется по срав-нению с фоновыми показателями снижением его концентрации в со-матосенсорной
коре в 5,4 раза, спинном мозге в 5,0 раз, ретикуляр-ной формации среднего мозга в 4,1 раза, гипоталамусе
в 2,3 раза, таламусе в 1,7 раза и в гиппокампе в 1,5 раза. Наряду с этим отмеча-ется снижение
концентрации ДА в спинном мозге, соматосенсорной коре, гипоталамусе и таламусе в среднем в 1,5-2,0
раза на фоне от-сутствия изменений в ретикулярной формации среднего мозга и тен-денции к возрастанию
уровня этого моноамина в гиппокампе. Одно-временно зафиксирована тенденция к увеличению концентрации
НА во всех изучаемых образованиях мозга в среднем в 1,2 -1,4 раза за исключением таламуса, где
она в 1,5 раза снижается.
Результаты исследования дают основание полагать, что в иници-альном периоде формирования острой
соматической боли отмеча-ется тенденция к доминированию НА-ергического компонента на фоне одновременного
редуцирования адрен- и дофаминергических ком-понентов моноаминового спектра спинного и головного
мозга. Стр.16
Серотонин и гистаминергические механизмы мозга в инициальном периоде острой соматической боли
В.Г. Овсянников, А. Е. Шумарин
Ростовский государственный медицинский университет, г. Ростов-на-Дону
В экспериментах, выполненных на крысах-самцах линии Вистар изучены центральные серотонин- и
гистаминергические механизмы начального-наименее изученного периода формирования острой соматической
боли.
Инициальный период острой соматической боли моделировали путем электрокожного раздражения задней
конечности животного в течение 10-15 сек. Изменения содержания серотонина (С) и его об-мена в
исследованных образованиях мозга характеризовались опре-деленной общностью и проявлялись по сравнению
с фоновыми зна-чениями увеличением уровня С в мозговой ткани, причем наиболее выражено в спинном
мозге - в 3,1 раза, ретикулярной формации сред-него мозга в 3,8 раза, в соматосенсорной коре в
2,4 раза, в гиппокам-пе в 2,3 раза. В других структурах - гипоталамусе и таламусе изме-нения содержания
С были менее выражены. Одновременно зареги-стрировано увеличение по сравнению с фоновыми значениями
кон-центрации в мозге основного метаболита С - 5-оксииндолуксусной кислоты (5-ОИУК): в ретикулярной
формации в 2,7 раза, спинном мозге и гиппокампе в 2,2 раза, в соматосенсорной коре в 1,8 раза,
гипоталамусе в 1,5 раза и только в таламусе уровень 5-ОИУК прак-тически не отличался от фонового.
Наряду с этим, сдвиги в соотно-шении 5-ОИУК/С, указывающего на изменения процессов инактива-ции
С, менялись преимущественно однотипно - в сторону сниже-ния, но количественно эти изменения проявлялись
по-разному. Только для соматосенсорной коры и таламуса величина данного коэффици-ента незначительно
увеличивалась.
Изменения содержания гистамина (Г) в мозговых структурах ха-рактеризовались наиболее выраженным
увеличением концентрации Г в ретикулярной формации в 6,2 раза и гиппокампе в 2,5 раза, а в спинном
мозге, соматосенсорной коре и таламусе в меньшей степе-ни (в среднем в 1,5 раза) и только в гипоталамусе
зарегистрировано незначительное снижение уровня этого моноамина.
Полученные результаты позволяют предполагать, что централь-ные серотонин- и гистаминергические
системы играют важную роль в общей цепи нейрогуморальных реакций организма, формирующихся в инициальный
период острой соматической боли. Стр.17
Некоторые вопросы метаболизма эндогенных опиатов при острой болевой травме и электроакупунктуре
Л.А.Назырова, И.Ю.Шумилова
Научный центр хирургии им. акад. В. Вахидова МЗ РУз,
г. Ташкент
Метаболизм эндогенных опиатов (ЭО) - наименее изучен среди большого класса биологически активных
веществ и ограничен отдель-ными сообщениями по распаду этих субстанций в условиях in vitro или
на изолированных препаратах.
Цепь исследования: на основе определения вено-артериальной разницы концентраций ЭО изучить их
метаболизм при острой боле-вой травме под защитой электроакупунктуры (ЭАП).
Материал: У16 собак после премедикации болевую травму под защитой ЭАП вызывали раздражением париетальной
плевры. ЭАП проводили в точках GI4, TR4-8, Р1 сила тока 250-500мА. В артери-альной и венозной
крови определяли концентрации ЭО: р-эндорфи-на ((3-ЭНД), метионин- и лейцин-энкефалинов (МЭК,
ЛЭК) радиоим-мунологическим методом. Исследования проводились в исходном состоянии (I этап), через
15(11), 30(111) и 60(IV) минут от начала воз-действия.
Результаты: На протяжении всего периода изучения концентра-ций энкефалинов и рХЭНД в артериальной
и венозной крови, досто-верная вено-артериальная разница выявлена у МЭК на 111 этапе ис-следования,
ЛЭК-на I и III этапах, р-ЭНД-на II этапе. При этом концентрация каждого суб-страта в артериальной
крови была мень-ше, чем в венозной: МЭК- на 25%, ЛЭК- на 80% (I этап) и 34% (111 этап), Р-ЭНД
на 55,5% (р<0,05). Примечательно, что ЛЭК подвергал-ся метаболизму лишь при увеличении его
концентрации в венозной крови до уровня 248-250 пг/мл. Это позволило предположить о вклю-чении
в данных условиях механизмов саморегуляции по поддержа-нию нормальных его концентраций в артериальной
крови.
Заключение: При остром болевом воздействии и ЭАП в крови цир-кулируют определенные концентрации
ЭО, которые участвуют в реа-лизации защитных реакций организма в момент болевого стресса, но при
чрезмерно высоком их содержании, видимо, включается эн-кефалиназный или аминопептидазный механизм
их расщепления, что регулирует содержание эндогенных опиатов в плазме артери-альной крови. Стр.18
Состояние нитрооксидергических структур при острой боли
В.Б.Шуматов, Т В.Балашова, Т.А.Шулштова Медицинский университет, г.Владивосток
Исследования последних лет указывают на синтез оксида азота при болевой импульсации (Cousins.Siddall,
1996,1998).Мощное ноци-цептивное воздействие при травматическом повреждении и при хи-рургической
операции создает условия для развития первичной и вто-ричной гипералгезии вследствие сенситизации
периферических бо-левых рецепторов, спинальных и супраспинальных ноцицептивных структур.
Целью нашего исследования явилось изучение состояния МО-ер-гических механизмов при развитии первичной
и вторичной сенсити-зации.
Изучили нитрооксидсинтазную активность протонеиронов спи-нальных ганглиев и нейронов Роландова
вещества спинного мозга, которое современная наука рассматривает как "ворота" боли.
Мате-риал исследования был получен от лица со смертельной травмой не позднее 16 часов от момента
биологической смерти.
Нитрооксидсинтазу (NOS) определяли гистохимической реакци-ей на НАДФН-диафоразу методом Нори,
Vincent (1989), NOS НАДФН-диафораза - два парных солокализованных в клеточных структурах фермента
с зависимо и синхронно меняющейся активностью. Ак-тивность NOS соответствует уровню секреции оксида
азота (NO). Ко-личественную оценку фермента проводили на микродеситометре "Vickers-M85".
В качестве контроля были выбранны плоды челове-ка 24-37 недель, когда органы в основном сформированы,
но еще не подвергались воздействию внешней среды.
Наши исследования показали образование и высвобождение NO нейронами спинальных ганглиев и нервными
клетками, расположен-ными в области студневидного вещества задних рогов спинного моз-га. Экспрессировали
фермента клетки мелкого и среднего размеров. При смертельной травме более чем в 4 раза увеличивалось
число NO-продуцирующих клеток с высокой и средней активностью фер-мента. Усиление активности протонеиронов
наблюдалось за счет синтеза индуцибельной NOS.
Полученные данные свидетельствуют об активном участии NO-ергических механизмов в процессах первичной
и вторичной гиперал-гезии. Стр.19
Нитрооксидсинтазные механизмы антиноцицептивного эффекта морфина
В.Б.Шуматов, Т.А.Шуматова, Т.В.Балашова Медицинский университет, г.Владивосток
В работах Stein (1995) получены данные, которые в противопо-ложность общепринятым представлениям
указывают, что опиоиды вызывают анальгетический эффект за счет взаимодействия с пери-ферическими
рецепторами нейронов спинальных ганглиев. Целью нашего исседования было изучение влияния морфина
на нитроок-сидсинтазную активность протонейронов спинальных ганглиев в мо-дели острой травмы (боли)
у белых половозрелых крыс.
Гистохимическая реакция локализации НАДФН-зависимой NO-синтазы проводилась по методу Nope, Vincent,
1998. Количествен-ные исследования активности выполнены на микроденситометре "Vickers-M85".
По активности нитрооксидсинтазы (NOS) судили об уровне оксида азота, так как количество продуцируемого
газа нахо-дится в прямой зависимости от активности фермента, его образую-щего.
При специфической реакции на НАДФН-диафоразу у здоровых крыс NO-ергическую активность проявляло
до 40% нейронов. Это были нейроны со средней и низкой активностью энзима. При моде-лировании острой
боли у экспериментальных животных регистриро-вали увеличение числа протонейронов с нитрооксидсинтазной
актив-ностью. На фоне выраженного болевого синдрома число клеток, име-ющих высокую активность
NOS, возросло в 2,4 раза.
Для изучения влияния морфина на спинальные ганглии его вво-дили эпидурально в поясничном отделе
здоровым животным и с мо-делью острой боли. Установлено снижение числа NOS-позитивных нейронов
у здоровых крыс в спинальных ганглиях грудного отдела в 2 раза, поясничного отдела - в 4 раза.
У травмированных животных вве-дение морфина также вызывало значительное снижение количества NO-экспрессирующих
нейронов за счет числа клеток с высокой и средней активностью энзима.
Наши исследования свидетельствуют, что сенситизация ноцицеп-торов при острой травме сопровождается
увеличением нитрооксид-синтазной активности нейронов спинальных ганглиев, при введении морфина
наблюдается подавление индуцированного травмой синте-за оксида азота. Таким образом, проведенные
исследования подтвер-ждают наличие периферического компонента болеутоляющего эф-фекта морфина.
Стр.20
Спектральный анализ дозозависимого влияния морфина на биоритмы болевой чувствительности мышей
А.Н. Кубынин
Санкт-Петербургский Государственный медицинский университет, Санкт-Петербург
В хронофармакологических исследованиях традиционно изучает-ся ритмичное колебание эффекта препаратов
в течение времени, то есть рассматривается влияние фактора времени на действие препа-рата. Однако,
в свою очередь лекарственные средства - анальгети-ки, нейролептики - изменяют исходные свойства
ритмики не только болевой чувствительности, но и локомоторной активности, то есть базовый суточный
ритм активности животных (собственные данные). Факт наличия у исследуемых препаратов хронотропного
эффекта по-ставил вопросе его зависимости от дозы. Разрешение данного воп-роса и составило цель
настоящего исследования.
У мышей линии SHR, содержавшихся в стандартном световом режиме (СТ = 12:12), болевую чувствительность
оценивали в тесте tail-flick через 20 мин после внутрибрюшинной инъекции морфина в нерегулярном
режиме 8 раз в течение 50 ч. Выполнялся спектраль-ный анализ рядов наблюдений в группах животных,
получавших мор-фин в дозах 1, 5 и 10мг/кг, и интактных мышей.
У интактных животных выявлены пики периодограммы, соответ-ствующие ритмам с длиной периода около
6, 8,12 и 24 ч. Акрофаза циркадианного ритма (минимум болевой чувствительности) прихо-дилась на
15-17ч. В группе животных, получавших морфин в дозе 1 мг/кг, были подавлены 12-ти и 24-часовая
ритмики, самостоятель-ной составляющей периодограммы стала 14-16-часовая. Принуди-тельный расчет
акрофазы суточного ритма показал, что минимум болевой чувствительности сместился в противофазу
- на 03 - 05 ч. При введении морфина в дозе 5 мг/кг 12-часовой ритм был также подавлен, суточный
ритм восстановился, но наиболее мощным стал 14-16-часовой пик. Акрофаза циркадианного ритма сместилась
на время утренней смены освещения (09 -11 ч). У животных, получав-ших морфин в дозе 10 мг/кг,
спектральный анализ выявил периодо-грамму, близкую к контрольной - мощность 14-16-часовой составля-ющей
снизилась, частично восстановился 12-часовой ритм. Тем не менее, акрофаза суточного ритма, как
и при введении 5 мг/кг, прихо-дилась на утреннее время (09 -11 ч).
Таким образом, хронотропный эффект морфина имеет дозозави-симый характер. Стр.21
Исследование механизма действия агониста к-опиатных рецепторов u-50488 на тромбоциты
И.В.Миндукшев, М.Р.Сакаев, Ю.Д.Игнатов, Н.Н.Петрищев ИЭФБ им. И.М.Сеченова, СПбГМУ им. И.П.Павлова, г. Санкт-Петербург
Ранее было показано, что агонист к-опиатных рецепторов U-50488 вызывает угнетение агрегации
тромбоцитов (Игнатов Ю.Д. и др. 1998). При экспрессии РНК к-опиатного рецептора в ооциты Xenopus,
Kaneco S. (1994) было показано, что U-50488 вызывал мобилизацию Са2* из внутриклеточного депо
и стимулировал продукцию цАМФ. Эти эффекты ингибировались коклюшным токсином, что дает возмож-ность
предположить об участии G0- и G-белки в трансдукции сигна-ла. При исследовании механизма действия
U-504888 на тромбоци-ты кролика был использован новый метод малоуглового светорассе-яния (Деркачев
Э.Ф., Патент RU 2108579,1996). Метод позволяет независимо регистрировать активацию и агрегацию
тромбоцитов в солевой среде без предварительной отмывки клеток от плазмы. По-казано, что быстрое
увеличение интенсивности светорассеяния в угле 12 градусов при внесении агониста агрегации связано
со сферизаци-ей тромбоцитов, вызванной повышением уровня внутриклеточного кальция, с полезной
величиной сигнала 30-60 %, агрегация регист-рируется в угле 2 градуса.
Установлено, что агонист к-опиатных рецепторов U-50488 вызы-вает активацию тромбоцитов. Пороговая
доза - 20 цМ. Данный эф-фект полностью сохранялся в безкальциевой среде (5тМ ЭДТА), что свидетельствуете
мобилизации Са2* из внутриклеточного депо. Пос-ле активации тромбоцитов U-50488 в насыщающей концентрации
500 цМ, агрегация, индуцируемая АДФ (20 цМ), полностью угнетается. Последний эффект вероятно связан
со стимуляцией U-50488 про-дукции цАМФ. Известно, что цАМФ вызывает активацию Са-АТФа-зы. Для
снятия влияния цАМФ оценку величины полумаксимально-го действия U-50488 на активацию клеток проводили
в присутствии 10 цМ адреналина. Получено значение ЕС" -110 цМ
Исследовано действия U-50488 на агрегацию. В качестве пара-метра, отражающего прохождение агрегации,
использовали началь-ную скорость реакции VH. При оценке константы ингибирования аг-регации К,
применен графический метод зависимости 1Л/н от I, где 1 - концентрация U-50488. Агрегацию вызывали
0.4 шМ и 1цМ АДФ. Величина К ~20цМ.
Таким образом, полученные данные свидетельствуют о возмож-ности агониста к-опиатных рецепторов
U-50488 активировать фос-фолипазу С и аденилатциклазу. Стр.22
Экспериментальное изучение механизмов действия допаминергических препаратов при мигрени
А.В.Амелин, К.Д. Игнатов, В.Е. Иванов Институт фармакологии Санкт- Петербургского государственного медицинского университета им. акад. И. П. Павлова, г. Санкт-Петербург
Цель работы. В последние годы активно обсуждается рольдопа-минергической системы в патогенезе
мигрени. Имеются данные об участии этой нейрохимической системы в регуляции боли и аналге-зии.
Клинические данные свидетельствуют, что антагонист допамина метоклопрамид, назначенный в начале
приступа мигрени, не только уменьшает сопутствующие тошноту и рвоту, но также способен осла-бить
интенсивность головной боли. Механизм его антиноцицептив-ного действия при мигренозной головной
боли не изучен. На экспе-риментальных моделях, широко используемых для исследования механизмов
действия антимигренозных препаратов, были изучены антагонист допаминовых рецепторов метоклопрамид
(М) и агонист допаминовых рецепторов бромкриптин (Б).
Методы. Периферические механизмы препаратов были изучены на модели экстравазии131 йод- альбумина
плазмы, как ключевого по-казателя выраженности нейрогенного воспаления в твердой мозго-вой оболочке,
развивающегося в ответ на стимуляцию тройничного ганглия. Для исследования центральных механизмов
использована модель изучения спонтанной и вызванной нейронной активности, ре-гистрируемой в спинальном
ядре тройничного нерва в ответ на сти-муляцию верхнего сагиттального синуса (ВСС)
Результаты. Б в дозах 0,5; 1,0; 2,0 мг/кг и М в дозах 1,0; 2,0; 3,0 мг/кгне блокировали экстравазации131
йод-альбумина плазмы, выз-ванной стимуляцией тройничного ганглия. В опытах на 15 нейронах показано,
что Б в исследованных дозах либо не влиял (11 нейро-нов), либо увеличивал (5 нейронов) фоновую
и вызванную стимуля-цией ВСС частоту разрядов нейронов. Увеличение нейронной актив-ности развивалось
через 10-15 минут после введения и сохраня-лось в течении 90 минут. М (2,0 и 3,0 мг/кг) в опытах
на 20 нейронах чувствительных к стимуляции ВСС, через 15-20 минут после в/в введе-ния достоверно
уменьшал на 40 - 60 % спонтанную (17 нейронов) и на 20 - 30 % вызванную (12 нейронов) частоту
разрядов нейронов. Увеличение спонтанной активности при введении М зарегистриро-вано у 3 нейронов.
Заключение. Наши исследования показали, что Б и М не подав-ляют нейрогенного воспаления в твердой
мозговой оболочке, являю-щегося важным периферическим механизмом инициации мигренозной головной
боли. В то же время М подавлял как спонтанную, так и вызваннную стимуляцией сосудов твердой мозговой
оболочки (ВСС) активность сенсорных нейронов спинального ядра тройничного не-рва, которые являются
первыми релейными нейронами, контроли-рующими проведение ноцицептивной информации от сосудов твер-дой
мозговой оболочки в таламус и кору головного мозга.
Таким образом, антиноцицептивная активность М при мигреноз-ной головной боли обусловлена центральными
механизмами дей-ствия препарата и связана с блокадой ноцицептивной информации на уровне ядра тройничного
нерва. Стр.23
Влияние баклофена на роль левого и правого полушарий головного мозга в регуляции болевой чувствительности и аналгезии у мышей
В. В..Михеев
Институт фармакологии Санкт-Петербургского государственного медицинского yituaept итета им.акад.И.П.Павлова,
г.Санкт-Петербург
В последнее время показано, что у мышей инбредных линий одно из полушарий поддерживает оптимальный
для данной линии уро-вень болевой чувствительности, а другое - играет анализирующую роль. Исследования
с применением морфина выявили важную роль опиатной системы в таком межполушарном разделении функций.
Поиск новых высокоэффективных ненаркотических аналгетиков по-казал перспективность применения
препаратов, влияющих на адре-нергическую и ГАМК-ергическую системы. Однако до сих пор не ис-следовано,
на какое полушарие в большей степени влияют эти пре-параты. Цель настоящей работы состояла в изучении
влияния аго-ниста ГАМК-рецепторов на межполушарную асимметрию регуляции болевой чувствительности.
Опыты проводили на 94 самцах мышей линии BALB/C. Болевую чувствительность оценивали в тесте "tail-flick"
Временного выклю-чения одного из полушарий достигали с помощью распространяю-щейся КС1 депрессии.
Баклофен в дозе 10 мг/кг вводили внутрибрю-шинноза 15 минут до тестирования.
Инактивация левого полушария (активно правое) увеличивала латентный период отдергивания хвоста
на 46,7% (р<0,01), тогда как выключение правой гемисферы (активна левая) было неэффектив-но.
Следовательно левое полушарие поддерживает исходный (опти-мальный) уровень болевой чувствительности,
а правое выполняет аналгезирующую функцию. У мышей с интактным мозгом баклофен увеличивал латентный
период на 108,3% (р<0,05), что свидетельству-ет о его высокой аналгетичекой активности. При
активном правом полушарии баклофен увеличивал этот показатель на 79,8% (р<0,05), а при активном
левом - на 281,5% (р < 0,001).
Таким образом, баклофен в большей степени влияет на полуша-рие, поддерживающее исходный уровень
болевой чувствительности, в результате чего исчезают межполушарные различия и обе гемис-феры начинают
выполнять аналгезирующую функцию. Стр.24
Оценка состояния соматосенсороной афферентации у подростков с болевой диабетической полиневропатией
Е.И.Карпович, А.В.Густое, Е. Ф.Лукушкипа Государственное учереждение "Областная детская клиническая больница", г.Нижний Новгород
Исследовано состояние сенсорной афферентации у 37 подрост-ков с болевой диабетической полиневропатией
(ДПНП) по данным анализа соматосенсорных вызванных потенциалов (ССВП), получен-ных при стимуляции
срединного и большеберцового нервов. Диагноз ПНП установливался на основе клинико-электронейромиографичес-ких
(ЭНМГ) критериев. Анализировались ВП плечевого сплетения в точке Эрба, спинальный и париетальный
корковый ВП. Рассчитыва-лось время проведения по афферентному сенсорному пути на участ-ке плечевое
сплетение - спинной мозг центральное время проведе-ния (лемнисковый путь в кору).
Изменения проводимости по проксимальным отделам аффе-рентного сенсорного пути у 32,4% больных,
что характеризовалось увеличением времени проведения на участке точка Эрба-спинной мозг в диапазоне
4, 08-6,2 м сек (при норме 3,23+0,4) .У 35,1% выявлено снижение проведения по лемнисковому пути
в кору в диапазоне 6,6-8,1 мсек (при норме 5,4+0,12). Нарушение проведения на обоих уча-стках
сенсорного пути выявлено у 8,1 % . Изменения корковых пари-етальных ВП отмечены у 54% больных,
что характеризовалось сни-жением амплитуды компонентов Р25 N 32 при стимуляции средин-ного нерва
и P38N 46 при стимуляции большеберцового нерва, их выпадением, обеднением формы потенциала или
увеличением пи-ковых латентностей. Нарушение их характеризует поражение быст-ропроводящих хорошо
миелинизированных волокон лемнисковой системы. Таким образом при болевой диабетической ПНП имеет
место поражение на всех участках сенсорного пути, как на централь-ном, так и на периферическом
уровнях. Стр.25
Диабетическая полинейропатия - клинико-электрофизиологические сопоставления
П.И. Пилипенко, Е.В. Вострикова г.Новосибирск
Диабетическая пол инейропатия - осложнение сахарного диабета (СД), ухудшающее качество жизни
и ведущее к ранней инвалидиза-ции больных. До настоящего времени окончательно не известны мно-гие
патогенетические механизмы диабетической полинейропатии. В современной зарубежной литературе появляются
исследования, в ко-торых поражения трофических нервных волокон и аксональная ише-мия рассматриваются
как одни из вероятных причин диабетической полинейропатии. Вместе с тем, состояние двигательных
про-водни-ков центральной нервной системы является наименее изученным звеном в патогенезе диабетической
полинейропатии.
Цель работы - изучение электрофизиологических параметров гло-бальной, стимуляционной электромиографии
(ЭМГ) и транскрани-альной магнитной стимуляции (ТКМС) у больных с диабетической полинейропатией.
Одной из задач исследования было сопоставле-ние результатов электрофизиологического обследования
с характе-ром болевого синдрома и другими проявлениями полинейропатии у
пациентов с СД.
Было обследовано 40 больных с СД I типа: мужчин - 27, женщин -13. Средний возраст больных- 35,5±10,9
года, средняя длитель-ность СД -11,4±8,4 года; средняя длительность полинейропатии -7,9±5,5 года.
С впервые выявленным диабетом обследовалось 3 че-ловека.
Обследование больных состояло из трех диагностических этапов:
I этап -сбор анамнеза и выяснение жалоб, характерных для мотор-ной, сенсорной и автономной дисфункций.
В основу данного этапа положен опросник EVRODIAB;
II этап - тщательное стандартное неврологическое обследование;
III этап - электрофизиологическое обследование. Оно включало ТКМС, дающую представление о состоянии
центральных двигатель-ных нервных волокон и ЭМГ, позволяющую судить о периферичес-ких двигательных
проводниках.
В данной работе изучались латентное™ моторных вызванных от-ветов в мышцах кисти и стопы при корковой,
цервикальной, люм-бальной стимуляции магнитным полем. Стимуляционная ЭМГ по-зволяла оценить двигательные
порции п. ulnaris и п. peroneus. Оце-нивалась также скорость проведения импульса по центральным
и периферическим двигательным проводникам. Применение данного комплекса обследования позволило
свести к минимуму вероятность невыявления имеющейся у больного диабетической полинейропа-тии.
Результаты исследования показали, что диабетическая полиней-ропатия диагностирована у 40 больных
(100%). ТКМС и ЭМГ помогли выявить диабетическую полинейропатию при отсутствии клини-ческой картины
у 2 чел (5%).
Интенсивность болевого синдрома варьировала от умеренного у 16 чел (40%) до выраженного у 12 чел
(30%). Выраженность болево-го синдрома не всегда сопровождалась выраженными патологичес-кими параметрами
электрофизиологических методов исследования. Удлинение течения СД и диабетической полинейропатии
у 30 чел (75%) сопровождалось нарастанием болевого синдрома. Максималь-ные болевые ощущения наблюдались
у 9 (75%) из 12 человек при длительности СД более 10 лет и диабетической полинейропатии бо-лее
5 лет. Электрофизиологическое обследование этих больных вы-явило выраженные денервационные изменения.
Скорость проведе-ния нервного импульса составила по п. ulnaris 39±5,1 м/с, по п. peroneus 28±2,5
м/с.
Выводы:
1. Если периферические нервные волокна подвержены патологи-ческим изменениям у больных СД с явлениями
полинейропатии, то говорить о достоверном изменении центральных двигательных про-водников не представляется
возможным.
2. Болевой синдром занимает в структуре клинических проявлений диабетической нейропатии одно из
ведущих мест. Зависимость бо-левого синдрома от степени денервационных изменений является очевидной
и перспективной в плане дальнейшего изучения причин и лечения боли при сахарном диабете. Стр.26
Влияние неспецифической противовоспалительной терапии на катехоламиновый обмен у мужчин и женщин при хронической боли нейропатического генеза
В.Г.Овсянников, И.М.Котиева
Ростовский Государственный медицинский университет
Одно из ведущих мест в современной медицине среди тяжелых патологических синдромов, встречающихся
примерно у 90% боль-ных с различной патологией занимает хроническая боль. В связи с этим большой
интерес для исследования представляют адренерги-ческие механизмы, участвующие в формировании болевых
реакций, гемодинамических проявлениях боли, а также организации болеуто-ляющих систем мозга.
Целью нашего исследования было изучение изменений различых фракций катехоламинов (адреналин, норадреналин,
дофамин, дегид-рофенилаланин), у мужчин и женщин при хронической боли, вызван-ной корешковым синдромом
длительностью более 1,5 мес. Матери-алом для исследования явилась кровь и моча больных после проведенной
неспецифической терапии, которая включала, новокаиново-гидрокортизоновые блокады в поясничную
область, блокады с вита-минами В1, В6; антигистаминные препараты, ненаркотические анальгетики.
Для определения содержания катехоламинов в крови и в экскре-тируемой моче использовался биохимический
метод спектрометри-ческого анализа. Сравнительный анализ моноаминергической реакции у мужчин и
женщин при хронической боли после лечения показал ,что у мужчин отмечается незначительное увеличение
суммарной катехоламинер-гической активности по сравнению с периодом до лечения, в основ-ном за
счет адреналина, концентрация которого увеличивается в моче в 2,6 р. Причем, уровень норадреналина
и дофамина не изменяется, а дегидрофенипаланина - снижается на 40%. У женщин также проис-ходит
увеличение концентрации адреналина в моче (в 2 р.), однако полного восстановления его количества
до уровня здоровых лиц не происходит, на фоне общего продолжающегося угнетения катехола-минергической
активности. Стр.27
Половые особенности моноаминового обмена у мужчин и женщин
И.М.Катаева
Ростовский государственный медицинский университет
Так как имеются существенные различия в поведенческих и эмо-циональных проявлениях при боли
между мужчинами и женщинами, целью нашего исследования было изучение фоновой активности мо-ноаминового
обмена, участвующего в реализации различных функ-ций как ноцицептивной, так и антиноцицептивной
систем организма. Исследованию подвергались здоровые мужчины и женщины в воз-расте 20-25 лет без
сопутсвующей патологии. Материалом для ис-следования явилась кровь и моча .Для определения содержания
мо-ноаминов в крови и в моче использовался высокочувствительный метод спектрометрического анализа.
Сравнительный анализ моноаминового обмена у здоровых муж-чин и женщин показал, что у мужчин, по
сравнению с женщинами, превалирует активность катехоламинов (в 3,4 р.), причем экскретор-ная активность
всех 4-х фракций катехоламинов (адреналин, норад-реналин, дофамин и дигидрофениалаланин) у мужчин
выше, чем ^ женщин. Однако у женщин активную роль выполняет фракция серо тонина, о чем свидетельствует
более высокий экскреторный уровень его с мочой (в 4 р.) и повышенное содержание серотонина в крови}
женщин (в Зр.). Причем, метаболическая активность серотонина ин тенсивнее у мужчин.
Содержание гистамина в крови у мужчин и женщин практичеоа равное на фоне более высокой экскреторной
активности (в 2,6 р. данного моноамина с мочой у женщин Стр.28
Нейроиммунология боли
A.M. Василенко ММСИ, г. Москва
В большинстве экспериментальных и клинических наблюдений обнаруживается закономерная связь между
болевой чувствительно-стью и иммунным ответом. Активация антиноцицептивных механиз-мов приводит
к повышению порога боли и подавлению иммунного ответа. Иммунологическая и ноцицептивная сенситизация,
высокий уровень иммунного ответа сопряжены с повышением болевой чув-ствительности. Важная роль
в нейроиммунных механизмах принад-лежит опиоидэргической системе. Сочетание гипоалгезии со сниже-нием
иммунитета реализуется через опиоидные рецепторы ц- и 5-типа. Опиоидные рецепторы к- типа, опосредуя
аналгетический эф-фект, не подавляют, а, возможно, и потенцируют иммунный ответ. Ряд цитокинов,
известных ранее в качестве иммуномедиаторов, прини-мают активное участие в механизмах контроля
боли, а медиаторы ноцицепции - в регуляции иммунитета. Каскад взаимообусловлен-ных реакций, непременными
участниками которых являются цитоки-ны и нейропептиды, уже на уровне периферических ноцицепторов
образуют систему контроля боли. Все основные компоненты этой системы воспроизводятся на сегментарном
и вышележащих уров-нях реализации механизмов сочетанной регуляции боли и иммуните-та. Результаты
современных исследований побуждают к пересмотру существующих ныне представлений о взаимоотношениях
перифери-ческой и центральной частей системы контроля боли.
Концепция регуляторного континуума нейро-эндокринно-иммун-ных реакций позволяет сформулировать
новые гипотезы относительно индивидуальных стратегий адаптации. Сочетанные изменения поро-га боли
и иммунного ответа находят отражение в эмоциональных и поведенческих реакциях. Нарушения нейро-эндокринно-иммунных
взаимоотношений играют значимую роль в предрасположенности к развитию, патогенезе и клинике практически
всех форм болевых син-дромов, иммунодефицитных состояний, развитии толерантности и зависимости,
а также в механизмах рефлекторной и медикаментоз-ной аналгезии. Стр.29






