Патогенетическое обоснование противоболевых операций деструктивных зон задних корешков при поражениях корешков спинного мозга
**НИИ мозга РАМН, Москва
В последние годы появляется все больше публикаций об успешном применении методик деструкции входных зон задних корешков (ВЗЗК) спинного мозга (DREZ-операций - от англ, dorsal roof entry zone] для лечения тяжелою болевого синдрома, обусловленного поражением корешков спинного мозга |1- 3, 5, 7-9, 11 - 15]. Нами проанализированы результаты 179 DREZ-операций: 134 - при преганглионарном отрыве (авульсии) корешков плечевого сплетения и 45 - при постганглионарных поражениях корешков спинного мозга (при фантомном болевом синдроме, посттравматической и постгерпетической плексопа-тии, межреберной невралгии различного генеза, постмастэктомическом синдроме, онкологических заболеваниях, остеохондрозе позвоночника). Применялись следующие DREZ-операций: точечная деструкция, задняя селективная ризидиото-мия и их комбинация, сулькомиелотомия (при авульсии), ризомиелотомия ВЗЗК. В обеих группах эффективность DREZ-операций была достаточно высокой. При авульсии и постганглионарных поражениях получено, соответственно, 90 и 68,9 % хороших, 7,4 и 24,4 % средних, 2,6 и 6,7 % неудовлетворительных результатов, что свидетельствует о более низкой эффективности DREZ-oпeраций при постганглионарных поражениях в сравнении с таковой при авульсии.
Целью настоящей работы явилось изучение патогенетических особенностей формирования тяжелого хронического болевого синдрома при пост- и преганглионарном поражении нервных структур, формирующихся из корешков спинного мозга, в рамках обоснования применения деструктивных микрохирургических операций на ВЗЗК спинного мозга.
Экспериментальная часть работы выполнена на половозрелых самках крыс линии Wistar. Для моделирования болевого синдрома у крыс в условиях общей анестезии осуществляли постганглио-нарное повреждение стволов плечевого сплетения (1-я группа) и авульсию сплетения (2-я группа). Динамику развития болевого синдрома, его характер и выраженность оценивали по поведенческим реакциям лабораторных животных. На 101-е сутки со дня операции (срок, соответствующий наиболее выраженным ренаративным процессам в нервной системе) производили забор структур спинного и головного мозга для гистологического исследования. Препараты окрашивали по методу Ниссля, Шпильмейера, Грос-Биль-шовского и изучали при помощи световой микроскопии.
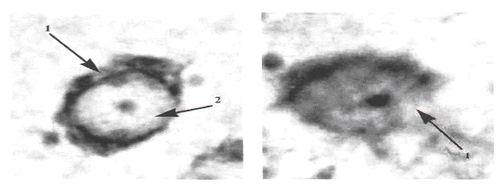
| Рис. 1. Чувствительный нейрон заднего рога с сегментарным хроматолизом (1), увеличением ядра и его эктопией (2). Окраска по Нисслю. Увеличение 10 х 90. Иммерсия. | Рис. 2. Кариолизис нейрона заднего рога. Окраска по Нисслю. Увеличение 10 х 90. Иммерсия. |
В группе животных с постганглионарным повреждением плечевого сплетения признаки выраженного болевого синдрома наблюдались у 6 (20 %) из 20 крыс. В аналогичном эксперименте при авульсии - у 20 (37 %) из 54 крыс.
Проведенные гистологические исследования в данных двух сериях экспериментов также выявили ряд различий. У животных с авульсией наблюдались выраженные морфологические изменения не только корешков плечевого сплетения, но и структур заднего рога. В микроскопической картине ВЗЗК выявлялась четкая зона с некротическим детритом. Вокруг этой зоны, на большом протяжении, формировались крупные лакуны, которые вместе с развивающейся дегенерацией белого вещества обусловливали status spongiosus. При постганглионарном повреждении на уровне травмы также обнаружены грубые изменения белого вещества: деформация и фрагментация миелиновых волокон, расширение периваскулярных и перифасцикулярных пространств. Данное явление криброзности белого вещества оптически напоминает status spongiosus при авульсии, однако, обусловлено не самой травмой, а только лишь восходящей дегенерацией вследствие повреждения нервных волокон на постганглионарном уровне. В области повреждения подобные изменения хорошо прослеживались, начиная с входных зон задних корешков. По мере удаления от места травмы эти патологические изменения становились более диффузными и менее регулярными.
Тем не менее первично нетравматические изменения на сегментарном уровне и в вышележащих отделах центральной нервной системы оказались однотипными в обеих группах. Они выражались в гетерогенных неспецифических патогисто-логических как деструктивных, так и репаративных изменениях нейронов и глии, соответствующих явлениям раздражения и перераздражения. Хроматолиз базофильного вещества цитоплазмы (тигроида) наблюдался в разной степени выраженности: сегментарный, перинук-леарный, субтотальный и тотальный (рис. 1). По мере распада базофильного вещества ядро также уменьшалось в размерах, происходил кариолизис (рис. 2) и, наконец, цитолиз. Такие изменения как набухание клеток, центральный и сегментарный хроматолиз, увеличение и эктопия ядра являются признаками первичного раздражения нейрона (по классификации Ниссля) или ретроградной дегенерации. Субтотальный и тотальный хроматолиз, вакуолизация и набухание при сохранности выявления основных структур клетки соответствует так называемому "острому заболеванию клетки" (по классификации Ниссля) или острому набуханию (в терминологии Шпильмейера) и отражает состояние дальнейшего раздражения и возбуждения клетки. Обнаружение слабоокрашенных нейронов с расплавленными контурами, уменьшенным в объеме ядром, разрушенным фибриллярным аппаратом указывает на то, что все клеточные энергетические запасы израсходованы. Такие клетки находятся в состоянии парабиоза либо некробиоза. Эту стадию патологического процесса Ниссль обозначал как "тяжелое заболевание", а Шпиль-мейер - как расплавление клетки [6].
Нейроны, находящиеся в состоянии первичного раздражения, "острого" и "тяжелого" заболевания наблюдались как на сегментарном уровне (в большей степени на стороне поражения), так и в структурах головного мозга (супраоптическом ядре гипоталамуса, вентробазальном комплексе таламуса и сенсомоторной коре). Нужно заметить, что данные определения отражают схематичный, фиксированный взгляд на патологический процесс, стадии которого могут переходить одна в другую с разной скоростью в отдельно взятых нейронах. Поэтому на микропрепарате можно было наблюдать в одной клетке различные изменения, либо в одном поле зрения увидеть нейроны, находящиеся на разных стадиях одного процесса.
Гиперхроматоз (гиперхромия) характеризуется чрезмерным окрашиванием базофильного вещества и свидетельствует о повышенной активности нейрона. Гиперхроматоз может быть различным по степени выраженности, вплоть до тотального. При этом клеточные органеллы невозможно дифференцировать от цитоплазмы, наблюдается уменьшение клетки в размерах, деформация ее отростков. Наивысшим проявлением гиперхроматоза является инкрустация клетки глыбками базофильного вещества. В этом случае нервная клетка сильно уменьшена в размерах, происходит ее сморщивание, на фоне которого тигроид выталкивается на периферию тела нейрона и даже за пределы его оболочек (рис. 3). Такие нейроны обнаруживались в данном исследовании в большом количестве практически во всех исследуемых отделах центральной нервной системы крыс с развившимся болевым синдромом. Изменения данного типа отражают явление хронического перераздражения. Сочетание тотального гиперхроматоза и инкрустации оболочек тифоидом расценивалось как "хроническое заболевание нейронов", находившихся в состоянии перевозбуждения. В функциональном отношении инкрустация свидетельствует об активном торможении нейрона вплоть до состояния парабиоза. В терминологии Ниссля это явление соответствует хроническому заболеванию нейрона |6|. Действительно, гиперхромные нейроны всегда встречаются при любых хронических органических процессах в нервной системе.
Наряду с вышеперечисленными деструктивными изменениями нейрональных элементов во всех отделах центральной нервной системы имелись признаки репаративных процессов. Они выражаются в появлении базофильного вещества в цитоплазме (появление глыбок нисслевского вещества начинается с периферии клетки), регенерации структуры нейрона, в том числе и нейрофибрил-лярного аппарата. Ядро занимает нормальное положение, происходит гипертрофия его ядрышка [6]. Однако перечисленные явления имелись в измененных по форме клетках, в которых сохранялся хроматолиз, что можно объяснить дистрофическими явлениями на фоне длительного состояния раздражения и возбуждения, приведших к истощению нейронов.
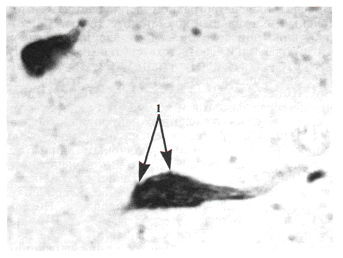
Рис. 3. Гиперхроматоз мотонейронов спинного мозга с инкрустацией мембраны глыбками базофильного вещества (1). Окраска по Нисслю. Увеличение 10 * 90. Иммерсия.
Перечисленные патоморфологические признаки являются неспецифическими и могут наблюдаться в любых отделах нервной системы при самых различных патогенных на нее воздействиях, будь то травма, ишемия, интоксикация или хронический стресс. В нашем исследовании таким патогенным фактором была травма с односторонним повреждением корешков плечевого сплетения, в результате которой произошла деафферентация нейронов задних рогов спинного мозга на соответствующем этому поражению уровне. Основополагающей причиной этих однотипных изменений является не уровень поражения (пре- или постганглионарный), а само явление деафферентации, в результате которой в задних рогах спинного мозга формируются патологические нейрональные ансамбли. В функциональном отношении они представляют собой генератор патологически усиленного возбуждения (ГПУВ) - основополагающее звено формирования хронического болевого синдрома [4]. Транснейрональная реакция в таком случае является патоморфологиче-ским эквивалентом сформировавшейся патологической алгической системы (ПАС), которая в свою очередь клинически соответствует болевому синдрому |4].
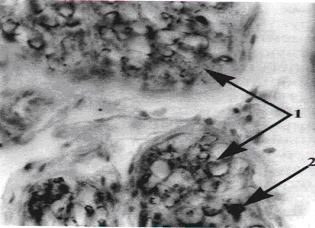
Рис. 4. Спинномозговые ганглии на стороне поражения. На фоне очагов ганглиозно-клеточных запустении (1) видны единичные нейроны с признаками репаративного процесса (2). Импрегнация по Грос-Бильшовскому. Увеличение 10 х 20.
Особое внимание заслуживает микроскопическая картина в спинномозговых ганглиях. При авульсии на стороне травмы выявлены грубые дегенеративные изменения в виде тотальной гибели нейронов. При постганглионарном поражении на стороне травмы явления нейрональной дегенерации были также ярко представлены: пе-рицеллюлярный отек, внутриклеточная вакуолизация, тотальный хроматолиз, атрофия, пикноз ядер, кариолизис и цитолиз. Вокруг погибших нейронов располагались в большом количестве ядра глии в виде так называемых глиальных узелков. Наличие последних отражает протекавший на момент взятия материала фагоцитоз погибших нейронов глиальными клетками (нейро-нофагия). Наряду с этим в большом количестве имелись очаги ганглиозно-клеточных запустении - участки, лишенные как нейронов, так и глиальных элементов, что соответствует уже со вершившимся процессам деструкции. Отличительной особенностью постганглионарного повреждения явилось обнаружение в спинномозговых узлах на стороне поражения нейронов, находящихся в состоянии репарации (рис. 4), что никогда не удавалось наблюдать при авульсии. Этот факт может служить ключом к объяснению более низкой эффективности DREZ-операций при постганглионарных поражениях, поскольку сохранившиеся нейроны спинномозговых ганглиев способны активировать ноцицептивные нейроны заднего рога через чувствительные волокна, идущие в переднем корешке. На противоположной поражению стороне патогистологические изменения в спинномозговых узлах выражались умеренными реакциями раздражения: гипертрофией нейронов с эктопией ядер, сегментарной гиперхромией.
Таким образом, результаты проведенного исследования указывают на общность механизмов формирования хронического болевого синдрома как на фоне пре-, так и постганглионарного поражения. Основными звеньями патогенеза при деафферентации задних рогов спинного мозга являются образование в них ГПУВ, в результате стойкой гиперактивности которого происходят системные функциональные и пластические перестройки на супраспинальном уровне с формированием ПАС. Деструктивные вмешательства на ВЗЗК направлены на дезинтеграцию первичного нейронального очага гиперактивности, а потому являются патогенетически обоснованными методиками лечения обеих форм нейрогенного болевого синдрома. Более низкая эффективность DREZ-операций при постганглионарном поражении может быть обусловлена активирующим влиянием сохранившихся нейронов спинномозговых узлов, что требует усовершенствования нейрохирургической тактики.
- Древаль О. Н. Болевые синдромы при поражениях плечевого сплетения (патогенез, клиника, микрохирургия): Дис. ... д-ра мед. наук. - М., 1991.
- Древаль О. Н., Кривицкая Г. Н., Акатов О. В. Морфологическое обоснование патогенетических предпосылок к противоболевым операциям в области входных зон задних корешков // Вопр. нейрохир. - 1996. - № 4. - С. 22-25.
- Кандель Э. И., Оглезнев К. Я., Древаль О. Н. Деструкция входной зоны задних корешков как метод лечения хронической боли при травматических повреждениях корешков плечевого сплетения // Там же. - 1987. - № 6. - С. 20-27.
- Крыжановский Г. Н. Общая патофизиология нервной системы. Руководство. - М., 1997.
- Селезнев К. Я., Древаль О. Н., Зарецкий А. А. и др. Ультразвуковая микрохирургия в лечении болевого синдрома // Новые ультразвуковые методы и приборы в биологии и медицине. - М., 1986. - С. 57.
- Снесарев П. Е. Теоретические основы патологической анатомии психических болезней. - М.: Медгиз, 1950.
- Шевелев И. Н. Клиника, диагностика и микрохирургическое лечение травматических поражений плечевого сплетения: Дис. ... д-ра мед. наук. - М., 1990.
- Friedman A. H., Bullitt E. Dorsal root entry zone lesions in the treatment of pain following brachial plexus avulsion spinal cord injury and herpes zoster // Appl. Neurophysiol. - 1988. - Vol. 51. - P. 164-169.
- Friedman A. H., Nashold B. S., Bronec P. R. Dorsal root entry zone lesions for the treatment of brachial plexus avulsion injuries: a follow-up study // Neurosurgery. - 1988. - Vol. 22, № 2. - P. 369-373.
- Nashold B. S., Urban В., Zorub D. S. Phantom pain relief by focal destruction of the substantia gelatinosa of Rolando // Adv. Pain Res. Ther. - 1976. - Vol. 1. - P. 959-963.
- Nashold B. S., Ostdahl R. H. Dorsal root entry zone lesions for pain relief// J. Neurosurg. - 1979. - Vol. 51. - P. 59-69.
- Rosomoff H. L. Stereotaxic cordotomy // Neurological Surgery / / Ed. J. R. Youmans. - Philadelphia, 1982. - P. 3672-3685.
- Siegfried J., Hood T. Current status of functional neurosurgery // Advances and Technical Standards in Neurosurgery / Ed. H. Krayenbuhl. - Wien: Springer-Verlag, 1983. - Vol. 10. - P. 19-79.
- Withringron R. H., Wynn-Parry С. В. Management of painful peripheral nerve disorders // J. Hand Surg. - 1984. - Vol. 98. - P. 24-28.
- Wynn-Parry C. B. Brachial plexus injuries // Br. J. Hosp. Med. - 1984. - Vol. 32. - P. 130-139.






