Невралгия тройничного нерва
НИИ нейрохирургии им. Н.Н. Бурденко, Москва
 Многовековая история изучения тяжелейшего недуга, получившего в 1671 г. название невралгии тройничного нерва (НТН), проявляющегося острыми рекурентными болевыми приступами в области лица, уходит своими корнями в XI - XII столетия (Wilkins R. H. et al.,1990,2001).
Многовековая история изучения тяжелейшего недуга, получившего в 1671 г. название невралгии тройничного нерва (НТН), проявляющегося острыми рекурентными болевыми приступами в области лица, уходит своими корнями в XI - XII столетия (Wilkins R. H. et al.,1990,2001).
Распространенность невралгии тройничного нерва (НТН) достаточно велика и составляет до 30 - 50 больных на 100 000 населения, а заболеваемость по данным ВОЗ находится в пределах 2 - 4 человек на 10 000 населения.
Чаще НТН встречается у женщин 50 - 69 лет и имеет правостороннюю латерализацию. Развитию заболевания способствуют различные сосудистые, эндокринно-обменные, аллергические расстройства, а также психогенные факторы. Считается, что НТН идиопатическое заболевание. Однако существует несколько теорий, объясняющих патогенез заболевания. Наиболее вероятная причина НТН заключается в сдавлении тройничного нерва внутри - или вне - черепа. Причинами сдавления могут быть опухоли, спаечные процессы после травм, инфекций, но чаще всего - дислокация и расширение извитых мозжечковых артерий, вен. Также возможной причиной является аневризма основной артерии. Среди внечерепных факторов отмечаются:
- формирование туннельного синдрома (сдавление 2 и 3 ветви в костных каналах - подглазничном отверстии и нижней челюсти при врожденной их узости и присоединении сосудистых заболеваний в пожилом возрасте),
- в результате местного одонто - или риногенного воспалительного процесса.
Под влиянием длительной патологической импульсации с периферии в спинномозговом ядре тройничного нерва формируется "фокус", подобный эпилептическому, генератор патологически усиленного возбуждения (ГПУВ) (Г.К. Крыжановский), существование которого уже не зависит от афферентной импульсации. Импульсы от триггерных точек поступают к ведущим нейронам генератора и вызывают его облегченную активацию. ГПУВ активирует ретикулярные, мезенцефальные образования, ядра таламуса, кору головного мозга, вовлекает лимбическую систему, формируя, таким образом, патологическую алгогенную систему.
Заболевание может развиться после удаления зуба (поражается луночковый нерв) - одонтогенная невралгия, в результате нарушения кровообращения в стволе мозга, в результате герпетической инфекции, редко вследствие демиелинизации корешка тройничного нерва при рассеянном склерозе. Боль при НТН имеет следующие характеристики:
- Приступообразный характер, длительность атаки не более 2 минут. Между двумя приступами всегда имеется "светлый" промежуток.
- Значительная интенсивность, внезапность, напоминающие удар электрическим током.
- Локализация строго ограничена зоной иннервации тройничного нерва, чаще 2 или 3 ветви (в 5% случаев 1-я ветвь).
- Наличие триггерных точек (зон), слабое раздражение которых вызывает типичный пароксизм (могут находиться в болевой или безболевой зоне). Наиболее часто триггерные зоны располагаются в ротолицевой области, на альвеолярном отростке, при поражении первой ветви у медиального угла глаза.
- Наличие триггерных факторов, чаще всего это умывание, разговор, еда, чистка зубов, бритье лица, движение воздуха, простое прикосновение.
- Типичное болевое поведение. Больные, стараясь переждать приступ, замирают в той позе, в которой застал их болевой пароксизм. Иногда растирают зону боли или совершают чмокающие движения. В период приступа больные отвечают на вопросы односложно, едва приоткрывая рот. На высоте пароксизма могут быть подергивания лицевой мускулатуры (tic douloureux).
- Неврологический дефицит в типичных случаях НТН отсутствует.
- Вегетативное сопровождение приступов скудное и наблюдается менее чем у 1/3 больных.
 Основным препаратом при лечении НТН является карбамазепин (финлепсин, тегретол). Карбамазепин способствует ГАМК-ергическому торможению в нейронных популяциях, склонных к пароксизмальным формам активности. Лечение начинают с дозы 0,1 x 2 раза в сутки. Затем суточная доза постепенно увеличивается до минимально эффективной. Не рекомендуется превышать дозу более 1200 мг/сут.
Основным препаратом при лечении НТН является карбамазепин (финлепсин, тегретол). Карбамазепин способствует ГАМК-ергическому торможению в нейронных популяциях, склонных к пароксизмальным формам активности. Лечение начинают с дозы 0,1 x 2 раза в сутки. Затем суточная доза постепенно увеличивается до минимально эффективной. Не рекомендуется превышать дозу более 1200 мг/сут.
Через 6 - 8 недель после наступления эффекта дозу постепенно уменьшают до минимальной поддерживающей или совсем отменяют.
У пациентов, применяющих препарат длительно, постепенно наступает снижение его эффективности. Кроме этого при длительном применении препарат вызывает токсическое поражение печени, почек, бронхоспазм, апластическую панцитопению. Могут возникать нарушения психики, снижение памяти, атаксия, головокружение, сонливость, диспептические расстройства. Известно, что препарат оказывает тератогенное действие.
Противопоказания к применению карбамазепина: предсердно-желудочковая блокада, глаукома, простатит, заболевания крови, индивидуальная непереносимость.
При его использовании необходимо периодически (1 раз в 2 - 3 месяца) контролировать общий анализ крови, биохимические показатели функций печени.
Из других антиконвульсантов для лечения НТН могут быть использованы дифенин (фенитоин), препараты вальпроевой кислоты (депакин, конвулекс).
Широко используются в комплексной терапии НТН баклофен, фенибут, пантогам. Их действие основано на восполнении дефицита ГАМК.
Оксибутират натрия применяется для купирования кризов. 5 мл 20% раствора вводится медленно внутривенно на 5% растворе глюкозы. Однако эффект одного введения непродолжителен (несколько часов). Препарат противопоказан при миастении. Необходим параллельный контроль калия в сыворотке крови (вызывает гипокалиемию).
В качестве дополнительного средства может использоваться аминокислота глицин, являющаяся в ЦНС тормозным медиатором. В форме миеглинола глицина, препарат в дозе 110 мг/кг растворяют в 50 мл воды. Курс лечения продолжается в течение 4 - 5 недель.
Немаловажное значение в терапии НТН имеют антидепрессанты, которые смягчают восприятие боли, устраняют депрессию, меняют функциональное состояние мозга. Наиболее эффективным считается амитриптилин в дозе 50 - 150 мг/сут.
Достаточно эффективны нейролептики (пимозид), транквилизаторы (диазепам).
У больных с сосудистыми заболеваниями головного мозга в схему лечения включают вазоактивные препараты (трентал, кавинтон и др.).
Для уменьшения активности "курковых" зон в острой стадии заболевания применяют местные анестетики - лидокаин, тримекаин, хлорэтил.
При аутоиммунных и аллергических процессах целесообразно применение глюкокортикоидов.
2. Физиотерапевтические методы.
Некоторый эффект в лечении НТН имеет применение иглорефлексотерапии, лазеропунктуры, импульсных токов низкого напряжения и низкой частоты, магнитных и электромагнитных полей, инфракрасного и ультрафиолетового излучения, ультразвука, электрофореза лекарственных веществ (например, 2% раствора ксидифона).
3. Ряд авторов рекомендуют проведение эфферентных методов терапии (плазмаферез, гемосорбция).
Хирургические методы.
Немало времени прошло и с момента, когда в 1748 г. Marshal и Schlichting получили первые результаты хирургического лечения данного заболевания. Однако, несмотря на столь длительный период изучения самой проблемы, а также большой опыт хирургического лечения этого заболевания и достижения современной нейрохирургии с учетом малоинвазивной хирургии и микрохирургии, многие вопросы лечения (выбор тактики, метода, прогнозирования результатов и др.) остаются открытыми. Общеизвестно, что сегодня существует огромное количество различных методов лечения НТН, что в основном показано в случае неэффективности консервативного лечения, эффект от которого незначителен, а в 30% случаев не отмечается вообще. Каждому методу присущи, как приемущества, так и недостатки (Тaho J; Teu J. M., 1996).
Оперативные вмешательства на центральных структурах разделяют на чрезкожные и посредством краниотомии.
К первым относят терморизотомию (чрезкожная высокочастотная селективная ризотомия), ретрогассериальную ризотомию глицеролом и балонную микрокомпрессию. Среди них терморизотомия наиболее эффективна и имеет значительно меньше побочных эффектов по сравнению с химической деструкцией.
Выбор того или иного метода во многом зависит от этиологического фактора, механизма и стадии патогенеза, а также соматического статуса и возраста больного в каждом конкретном случае, что необходимо учитывать перед выбором хирургического метода лечения тригеминалгии.
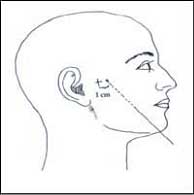 При использовании медикаментозных блокад, положительные результаты отмечаются в среднем у 35% больных, наибольшая эффективность отмечается при применении метода в период течения заболевания от 5 до 10 лет. 35% положительных результатов отмечается и после алкоголизации перефирических ветвей ТН. Но наиболее результативным, лечение данным методом, отмечается у больных с периодом заболевания, превышающем 10 лет.
При использовании медикаментозных блокад, положительные результаты отмечаются в среднем у 35% больных, наибольшая эффективность отмечается при применении метода в период течения заболевания от 5 до 10 лет. 35% положительных результатов отмечается и после алкоголизации перефирических ветвей ТН. Но наиболее результативным, лечение данным методом, отмечается у больных с периодом заболевания, превышающем 10 лет.
Крионейротомия чувствительной порции корешка ТН имеет весомые преимущества перед химической деструкцией - 65%, однако наиболее удовлетворительные результаты данного метода можно ожидать, если на момент операции период заболевания не превышает 5 лет.
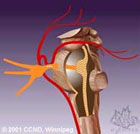
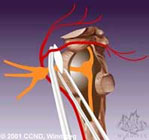 Наиболее адекватным и эффективным методом хирургического лечения больных с НТН при соответствующем генезе заболевания сегодня признан метод микрососудистой декомпресии (МСД) корешка тройничного нерва (ТН). Микроваскулярная декомпрессия заключается в трепанации задней черепной ямки, ревизии взаимоотношений корешка тройничного нерва, верхней и нижней передних мозжечковых артерий и верхней каменистой вены. При компрессии корешка сосудами их выделяют, а между сосудами и корешком помещают прокладку, предотвращающую контакт между ними и воздействие сосуда на корешок.
Наиболее адекватным и эффективным методом хирургического лечения больных с НТН при соответствующем генезе заболевания сегодня признан метод микрососудистой декомпресии (МСД) корешка тройничного нерва (ТН). Микроваскулярная декомпрессия заключается в трепанации задней черепной ямки, ревизии взаимоотношений корешка тройничного нерва, верхней и нижней передних мозжечковых артерий и верхней каменистой вены. При компрессии корешка сосудами их выделяют, а между сосудами и корешком помещают прокладку, предотвращающую контакт между ними и воздействие сосуда на корешок.
Однако, сосудисто - нервный конфликт не всегда является причиной НТН. Кроме того у больных с НТН, страдающих тяжелой сопутствующей соматической патологией, и больных в старческом возрасте проведение МСД противопоказано.
Этот метод позволяет несколько сократить число рецидивов, но является более травматичным.
Наиболее тяжелым осложнением микроваскулярной декомпрессии является ишемический инфаркт ствола мозга, нередко приводящий к летальному исходу (0,5 - 3 % случаев по данным разных авторов). К другим осложнениям относится повреждение блокового нерва, парез лицевой мускулатуры, снижение слуха, атаксия, возникновение гематомы мозжечка, воздушной эмболии, инфекционные осложнения.
Частота осложнений составляет 12 - 17%, а риск рецидивов от 3 до 47%.
Тригеминальная нуклеотрактотомия (разрушение чувствительных ядер тройничного нерва) имеет такой же высокий оперативный риск.
Как уже указывалось выше, наиболее эффективным методом, практически не имеющим серьезных осложнений, является метод радиочастотной деструкции корешка тройничного нерва. 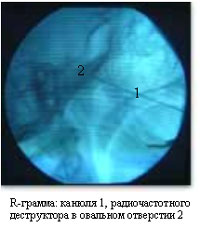 Радиочастотная деструкция базируется на физическом принципе термокоагуляции и основана на эффекте выделения тепловой энергии при прохождении через биологические ткани токов ультравысокой частоты. Электрод, подключенный к генератору тока, подводится к анатомической области, месту деструкции через изолированную канюлю. Интенсивность нагревания ткани зависит от ее сопротивления. Электрический ток проходит между активным или повреждающим электродом, погруженным в ткани тела, и индифферентным или рассеянным электродом. Теплопродукция, а вследствие этого и разрушение тканей, происходит только вокруг неизолированного кончика активного электрода. Основным преимуществом метода радиочастотной термодеструкции является то, что размер зоны повреждения может быть адекватно проконтролирован, а электрод с термодатчиком регистрирует температуру в зоне повреждения.
Радиочастотная деструкция базируется на физическом принципе термокоагуляции и основана на эффекте выделения тепловой энергии при прохождении через биологические ткани токов ультравысокой частоты. Электрод, подключенный к генератору тока, подводится к анатомической области, месту деструкции через изолированную канюлю. Интенсивность нагревания ткани зависит от ее сопротивления. Электрический ток проходит между активным или повреждающим электродом, погруженным в ткани тела, и индифферентным или рассеянным электродом. Теплопродукция, а вследствие этого и разрушение тканей, происходит только вокруг неизолированного кончика активного электрода. Основным преимуществом метода радиочастотной термодеструкции является то, что размер зоны повреждения может быть адекватно проконтролирован, а электрод с термодатчиком регистрирует температуру в зоне повреждения. 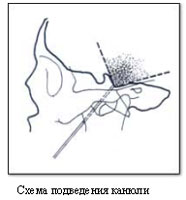 Существует возможность установки точного времени повреждения, а контроль электростимуляции и уровня сопротивления позволяет правильно и точно установить электрод. Одна и та же канюля может быть использована для различных методик деструкции в области позвоночного столба и полости черепа. Использование местной анестезии обеспечивает короткий восстановительный период и при необходимости возможны повторные сеансы радиочастотной термодеструкции.
Существует возможность установки точного времени повреждения, а контроль электростимуляции и уровня сопротивления позволяет правильно и точно установить электрод. Одна и та же канюля может быть использована для различных методик деструкции в области позвоночного столба и полости черепа. Использование местной анестезии обеспечивает короткий восстановительный период и при необходимости возможны повторные сеансы радиочастотной термодеструкции.
Критериями отбора больных для методики радиочастотной деструкции являются: длительность болевого синдрома более 4-12 месяцев; нестойкий эффект или его отсутствие после проводимой медикаментозной терапии; отсутствие грубых нарушений анатомических взаимоотношений; положительная диагностическая и прогностическая блокада, выполняемая до процедуры деструкции и помогающая локализовать причину хронических болей. Обязательными критериями отбора так же являются отсутствие наркотической зависимости и привыкания к седативным препаратам, алкоголю, отсутствие социальных и психологических факторов, доминирующих над восприятием боли.
длительность болевого синдрома более 4-12 месяцев; нестойкий эффект или его отсутствие после проводимой медикаментозной терапии; отсутствие грубых нарушений анатомических взаимоотношений; положительная диагностическая и прогностическая блокада, выполняемая до процедуры деструкции и помогающая локализовать причину хронических болей. Обязательными критериями отбора так же являются отсутствие наркотической зависимости и привыкания к седативным препаратам, алкоголю, отсутствие социальных и психологических факторов, доминирующих над восприятием боли.
Новые методы в лечении тригеминальной невралгии. Эпидуральная нейростимуляция моторной коры головного мозга.
В 1991 Tsubokawa и коллеги впервые опубликовали результаты серии наблюдений c описанием 8 больных с центральной нейропатической болю, в лечении которых использовалась стимуляция моторной зоны коры головного мозга (Motor Cortex Stimulation - MCS). Авторы исследования разработали показания, технику, гипотетические механизмы, и преимущества этого метода лечения. Эпидуральная MCS эффективна при тригеминальной нейропатии, бокового инфаркта ствола головного мозга, и инфаркта таламуса, ¹"anesthesia dolorosa", постгерпетической невралгии, повреждении (травмы) спинного мозга, постампутационной боли в конечности. Лучшие послеоперационные результаты наблюдаются при болях в тригеминальной области и в случае отсутствия или умеренного моторного дефицита в зоне боли. Существующая гипотеза объясняет эффективность MCS увеличением регионального мозгового кровотока в ипсилатеральном вентролатеральном таламусе, где преобладают кортикоталамические связи с двигательной и премоторной областями коры. Степень облегчения боли также коррелирует с увеличением кровотока в поясной извилине. Это обуславливает, уменьшение переживания боли (психологического ее компонента).
Показания:
Стимуляция двигательной коры должна применяться во всех случаях медикаментозно резистентных центральных нейропатических болей. Прогноз эффективности процедуры, лучше в тех случаях, когда внутривенное введение Тиамилала (в дозе 50 мг с постепенным - через каждые 5 мин. - наращиванием дозы до 250 мг максимум) вызывает регресс боли как минимум на 40 %. К синдромам, при которых показана MCS относятся: "anesthesia dolorosa" и другие формы тригеминальной деафферентационной боли, центральная боль после инсультов, постгерпетическая невралгия, периферические деафферентационные болевые синдромы, например при травме плечевого сплетения или седалищного нерва, травмы спинного мозга, и фантомная и/или культевая боль в конечностях
В своих ранних описаниях процедуры Tsubokawa, Meyerson, и соавторы производили операцию под местным обезболиванием. Теперь, в связи с современными возможностями нейронавигации может использоваться общая анестезия.
До операции к покровам черепа прикрепляются координатные метки, и производится МРТ (или КТ) со срезами в 1 мм. Идентифицируются контрлатеральная центральная борозда, Сильвиева щель, и нижняя и верхняя лобные извилины. Для интраоперационного контроля ЭС, применяются электромиографические электроды. Цель наносится по карте на кожу и производится линейный разрез, достаточно длинный для произведения краниотомии с костным окном 5 см в диаметре.  Эпидурально накладывается 16 - 20 - контактный электрод параллельно центральной извилине с захватом пре- и постцентральной извилин. Со срединного нерва регистрируются соматосенсорные вызванные потенциалы для идентификации изменений N20/P20 стадии, которые происходят в центральной борозде. Это обеспечивает электрофизиологическую идентификацию участка прецентральной извилины в зоне руки, расположенной краниально по отношению к лицевой области. Физиологические данные подтверждает анатомическая нейронавигация. С опытом, необходимость в нейронавигации может отпадать. Цель для имплантации электрода отмечается на твердой мозговой оболочке. Производится стимуляция лицевой моторной области с соответствующими параметрами. На контрлатеральной стороне лица наблюдаются мышечные сокращения. Электромиографические электроды размещаются в соответствующих группах мышц для регистрации этих сокращений.
Эпидурально накладывается 16 - 20 - контактный электрод параллельно центральной извилине с захватом пре- и постцентральной извилин. Со срединного нерва регистрируются соматосенсорные вызванные потенциалы для идентификации изменений N20/P20 стадии, которые происходят в центральной борозде. Это обеспечивает электрофизиологическую идентификацию участка прецентральной извилины в зоне руки, расположенной краниально по отношению к лицевой области. Физиологические данные подтверждает анатомическая нейронавигация. С опытом, необходимость в нейронавигации может отпадать. Цель для имплантации электрода отмечается на твердой мозговой оболочке. Производится стимуляция лицевой моторной области с соответствующими параметрами. На контрлатеральной стороне лица наблюдаются мышечные сокращения. Электромиографические электроды размещаются в соответствующих группах мышц для регистрации этих сокращений.
Когда соответствующая корковая цель подтверждается моторной стимуляцией, диагностический электрод удаляется, и четырех - или восьми контактный электрод размещается перпендикулярно к центральной борозде (рис. 1).
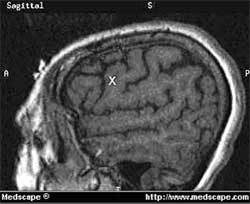
Рис. 1. Сагиттальный срез МРТ, демонстрирующий участок цели (X) у пациента с нейропатической лицевой болью. Цель расположена кпереди от центральной извилины и вблизи нижней лобной извилины.
Возможные осложнения могут быть представлены эпи- или субдуральной гематомой, постепенным уменьшением эффективности стимуляции и болезненной стимуляцией. Необходимо отметить, что при определенном опыте выполнения данной операции, эти осложнения встречаются очень редко. Регресс боли наступает в пределах нескольких минут и продолжается в течение многих часов после прекращения электрической стимуляции.
Заключение:
MCS - утвердившийся метод лечения для комплекса центральных нейропатических болевых синдромов с невосприимчивостью к консервативным методам лечения. Конечно, продолжение исследований предоставит много полезной дополнительной информации относительно хирургической техники, первичных показаний, и длительности эффекта MSC. За последние 10 лет, этот метод оказался методом выбора для пациентов, страдающих от наиболее тяжелых хронических болевых синдромов.
¹Анестезия Dolorosa
Возникающая вследствие повреждения (травмы) тройничного нерва, болезненная и одновремено нечувствительная область диагностируется как anesthesia dolorosa. Эта боль очень тяжелая и постоянная, описывается как жжение, "грызущее" ощущение, или в виде ощущения раны. Наиболее частая причина - деструктивные вмешательства по поводу тригеминальной невралгии.
Лечение: Консервативное лечение часто неэффективно. Хирургические вмешательства, включают трактотомию каудального ядра, стимуляцию глубиных структур и премоторной области коры головного мозга. В целом, дополнительные разрушительные вмешательства - не эффективны. Предпочтение следует отдавать методам нейромодуляции.






