Локальное введение глюкортикостероидов в лечении острых и хронических ревматических заболеваний
Е. Л. Насонов Обсуждаются вопросы фармакотерапии боли в ревматологической практике. Сравнение нескольких групп анальгетических средств, новые данные об их побочных действиях позволят врачам оказывать более квалифицированную помощь пациентам с болями различной природы. Pharmacological therapy of pain in rheumatologic practice is discussed. A comparison of different groups of analgesics, new data of their side effects will help to provide the patients with various kinds of pains with more qualified medical care. Современные стандарты рассматривают боль как одну из наиболее значимых проблем, имеющих не только медицинское значение, но и крайне неблагоприятные социально-экономические последствия. Лечение боли остается одной из наиболее актуальных и трудных задач медицины на протяжении всей истории человечества. Неадекватное обезболивание ведет к удлинению периода выздоровления, увеличению "стоимости" и ухудшению исходов болезней, снижению качества жизни, развитию кардиоваскулярных осложнений (артериальная гипертензия, нарушения ритма сердца и др.).
Острая, хроническая (и рецидивирующая) боль - ведущий клинический симптом заболеваний опорно-двигательного аппарата, большинство которых классифицируются как "ревматические болезни". "Ревматические" боли чрезвычайно широко распространены в популяции, они встречаются более чем у 30 % населения земного шара.
Для уменьшения боли в клинической практике используют несколько классов лекарственных средств: "простые" анальгетики - парацетамол (ацетаминофен), нестероидные противовоспалительные препараты (НПВП), которые объединяются термином - ненаркотические анальгетики, реже центральные анальгетики (трамадол), а также широкий спектр лекарственных препаратов, обладающих не прямой, а опосредованной анальгетической активностью [1-3]. НПВП занимают основное место в лечении острых и хронических болей, особенно связанных с развитием воспаления опорно-двигательного аппарата, и относятся к числу наиболее эффективных и широко применяемых в клинической практике лекарственных средств [2, 3]. Однако даже кратковременный прием НПВП может приводить к развитию побочных эффектов, которые в целом встречаются примерно в 25 % случаев, а у 5 % больных, особенно пожилого и старческого возраста, могут представлять серьезную угрозу для жизни. Именно поэтому в последние годы особое внимание привлечено к проблеме безопасного применения НПВП.
В последние годы возможности "анальгетической" терапии существенно расширились. Это во многом связано с разработкой нового класса НПВП - так называемых ингибиторов (селективных) циклооксигеназы (ЦОГ)-2. Эти препараты не уступают по эффективности "неселективным" НПВП, но менее токсичны, в первую очередь, в отношении желудочно-кишечного тракта (ЖКТ) [4, 5, 10, 29, 31]. Напомним, что ведущий механизм, определяющий как эффективность, так и токсичность НПВП, связан с подавлением активности ЦОГ - фермента, регулирующего биотрансформацию арахидоновой кислоты в простагландины (ПГ), простациклин и тромбоксан.
Идентифицировано две основные изоформы ЦОГ, которые обозначаются как ЦОГ-1 и ЦОГ-2 [13, 17]. Первая (ЦОГ-1) постоянно присутствует в большинстве тканей (хотя и в различном количестве), относится к категории "конститутивных" ("структурных") ферментов, регулирующих физиологические эффекты ПГ. Напротив, ЦОГ-2 в норме в большинстве тканей не обнаруживается, но ее уровень существенно увеличивается на фоне развития воспаления (схема 1). Ингибиция ЦОГ-2 рассматривается как один из важных механизмов противовоспалительной и анальгетической активности НПВП, а ЦОГ-1 - развития побочных реакций [13]. Поэтому высокую эффективность и токсичность "стандартных" НПВП связывают с их низкой селективностью, то есть способностью в одинаковой степени подавлять активность обеих изоформ ЦОГ. Особенно важное значение с точки зрения склонности НПВП вызывать поражение ЖКТ имеет их селективность в отношении изоформ ЦОГ. Действительно, как видно на схеме 2, риск тяжелых желудочно-кишечных осложнений существенно выше на фоне приема тех препаратов (индометацин, пироксикам и особенно кеторолак), которые обладают низкой селективностью в отношении ЦОГ-2.
Однако в последние годы появились новые факты о роли ЦОГ-зависимого синтеза ПГ в норме и патологии и ЦОГ-независимых механизмах эффективности и токсичности НПВП. Установлена физиологическая роль ЦОГ-2 зависимого синтеза ПГ в регуляции овуляции, функции почек, сердечно-сосудистой системы репарации переломов костей скелета [8]. Напротив, при некоторых формах воспаления ингибиторы ЦОГ-2 проявляют противовоспалительные эффекты только в очень высоких дозах, блокирующих активность не только ЦОГ-2, но и ЦОГ-1, и не влияют (в отличие от "неселективных" НПВП) на лейкоцитарную инфильтрацию в зоне воспаления. Имеются данные о ЦОГ-независимых центральных и периферических анальгетических эффектах НПВП и о способности "неселективных" НПВП оказывать более выраженное действие в отношении некоторых форм болей, по сравнению с ингибиторами ЦОГ-2 [8|.
Механизмы, определяющие анальгетическую (и жаропонижающую) активность парацетамола, остаются недостаточно изученными. Совсем недавно было показано, что точкой приложения парацетамола может быть еще один изофермент циклооксигеназы - ЦОГ-3, которая преимущественно экспрессируется в клетках коры головного мозга и особенно "чувствительна" к парацетамолу, а также метамизолу и фенацетину [12|. Слабая периферическая ЦОГ-ингибирующая активность позволяет объяснить, почему парацетамол, в отличие от НПВП, не обладает противовоспалительной активностью.
По селективности в отношении изоферментов ЦОГ ненаркотические анальгетики условно подразделяются на следующие группы (табл. 1).
Поскольку "ревматические" боли часто имеют "воспалительную" природу и носят хронический характер, их лечение имеет свою специфику, которая требует специального обсуждения |7, 9, 32]. Трудности, с которыми приходится сталкиваться врачу в процессе лечения болей при ревматических заболеваниях, очень хорошо видны на примере двух анальгетических препаратов: кеторолака и ацетаминофена.
Кеторолак, несомненно, относится к числу самых эффективных НПВП, который широко используется в клинической практике для купирования острых болей. Кеторолак является наиболее мощным ингибитором ЦОГ-1 среди всех НПВП. Однако для этого препарата характерна необычно высокая частота гастроэнтерологических побочных эффектов, которая существенно выше, чем у других НПВП. Кроме того, кеторолак негативно влияет на заживление переломов костей скелета, что также ограничивает сферу его применения даже для краткосрочного купирования острых болей.
С х е м а 1
ГУ Институт ревматологии РАМН, Москва
Ключевые слова: фармакотерапия боли
Key words: pharmacological therapy of pain
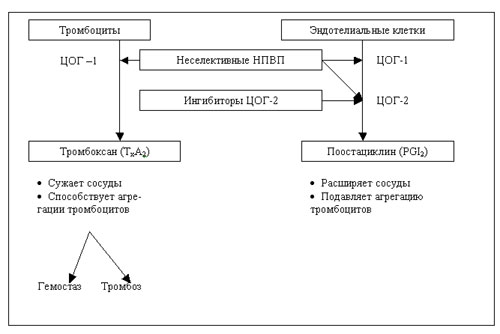
Действие НПВП и ЦОГ-2 ингибиторов на синтез ТхА2 и PGI2 (24)
С х е м а 2
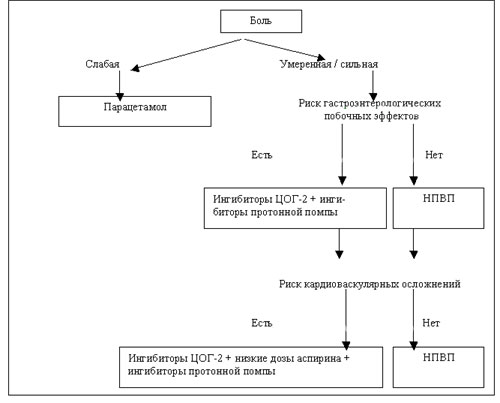
Алгоритм лечения боли и ревматологической практике
Та б л и ц а 1
Группы ненаркотических анальгетиков в зависимости от селективности к изоферментам ЦОГ
| Группы препаратов | Пример |
| Неселективные ингибиторы ЦОГ | · НПВП |
| Селективные ингибиторы ЦОГ-2 | · Коксибы (целекоксиб, рофекоксиб, вальдекоксиб, эторикоксиб, лумиракоксиб) |
| Селективные ингибиторы ЦОГ-3 | · Другие (мелоксикам, нимесулид, этодолак) |
| Селективные ингибиторы ЦОГ-1* | · Низкие дозы аспирина |
*Блокирует ЦОГ-1-завмсимую агрегацию тромбоцитов, но не обладает противовоспалительной и анальгетической активностью.
Парацетамол, напротив, в ревматологии применяют почти исключительно при умеренных хронических болях у пациентов с остеоартрозом. Очевидно, что показания для назначения НПВП существенно шире, чем для парацетамола. НПВП (включая ингибиторы ЦОГ-2) с успехом применяются при многих воспалительных ревматических заболеваниях (ревматоидный артрит, подагра, спондилоартриты и др.) [3], при которых парацетамол не эффективен. Даже при остеоартрозе анальгетический эффект у стандартных НПВП и ЦОГ-2 ингибиторов более выражен, чем у парацетамола [16]. Предварительные результаты свидетельствуют также о том, что ингибиторы ЦОГ-2 эффективны и при других заболеваниях опорно-двигательного аппарата и не уступают НПВП [23].
Недавно появились данные об отсутствии существенных различий по частоте гастроэнтерологических побочных эффектов у пациентов, получавших парацетамол и НПВП [22]. Фактически при приеме высоких доз парацетамола (4 г/сут) эти осложнения встречались с такой же частотой, как и приеме стандартных доз НПВП. Имеются данные, что ингибиторы ЦОГ-2 реже вызывают поражение ЖКТ, чем парацетамол. Кроме того, оказалось, что прием не только НПВП, но и парацетамола ассоциируется с достоверным увеличением риска артериальной гипертензии [14, 33]. К сожалению, ингибиторы ЦОГ-2 также оказывают нежелательное действие на функцию почек, сходную с таковым у НПВП [39]. Можно предположить, что преимущества парацетамола перед НПВП (и особенно ингибиторами ЦОГ-2) невелики и могут быть ощутимы только у очень "тяжелых" пациентов (с сердечной недостаточностью, неконтролируемой артериальной гипертензией и осложненным "язвенным" анамнезом) пожилого возраста.
Широко изучается вопрос о выборе оптимальной тактики противоязвенной терапии у пациентов с НПВП-индуцированным поражением ЖКТ. Препаратами выбора являются ингибиторы протонной помпы, которые почти полностью вытеснили блокаторы Н2-гистаминовых рецепторов (из-за низкой эффективности) и мизопростол (из-за неудовлетворительной переносимости). Применение ингибиторов ЦОГ-2 не позволяет полностью исключить риск тяжелых осложнений у определенной категории пациентов. Можно полагать, что наиболее оптимальной терапией у этих больных будет сочетанное применение ингибиторов ЦОГ-2 и ингибиторов протонной помпы.
Особое внимание в последние годы уделяется кардиоваскулярной и почечной безопасности ингибиторов ЦОГ-2, сосудистые эффекты которых (подавление синтеза PGI2 и отсутствие действия на синтез тромбоксана (Тх) А2) противоположны действию аспирина в низких дозах (подавление ТхА2 и отсутствие влияния на продукцию PGI2) и, исходя из теоретических предпосылок, могут приводить к усилению тенденции к гиперкоагуляции [22] (см. рис. 1). На основании мета-анализа результатов клинических испытаний целекоксиба и рофекоксиба был сделан вывод, что кардиоваскулярные осложнения являются класс-специфическими побочными эффектами ЦОГ-2 ингибиторов [28]. Однако это не нашло подтверждения в процессе дальнейших исследований.
Т а б л и ц а 2
Относительный риск (ОР) тяжелых гастроэнтерологических побочных эффектов (кровотечение, перфорация, обструкция) на фоне приема кеторолака и других НПВП.
| Препарат | |||
| G. Traversa и соавт. [ 37 ] | F. Menniti-Ippolito и соавт. [ 28 ] | L. A. Garsia-Rodrigues и соавт. [ 19 ] | |
| Кеторолак | 4,9 | 8,3 | 24,7 |
| Диклофенак | 1,7 | 3,8 | 2,7 |
| Напроксен | 1,1 | 5,3 | |
| Нимесулид | 1,2 | 2,1 | 4,4 |
| Пироксикам | 1,1 | 7,0 | 9,5 |
| Кетопрофен | 4,1 | 3,2 | |
| Теноксикам | 4,3 | ||
| Индометацин | 5,5 | ||
| Ибупрофен | 2,1 | ||
| Другие НПВП | 1,3 | 2,9 | 2,9 |
Следует подчеркнуть, что данные, касающиеся связи между приемом стандартных НПВП, ингибиторов ЦОГ-2 и риском кардиоваскулярных осложнений, остаются весьма противоречивыми [21, 36|. В настоящее время пациентам, принимающим НПВП (независимо от их ЦОГ-селективности), которые имеют кардиоваскулярные факторы риска, рекомендуется профилактическое назначение низких доз аспирина [8]. При выборе НПВП необходимо учитывать, что некоторые из них (например, ибупрофен и индометацин) обладают способностью отменять "антитромботический" эффект низких доз аспирина [11, 26], в то время как другие (кетопрофен, диклофенак), а также "селективные" ингибиторы ЦОГ-2 (целекоксиб, рофекоксиб) и парацетамол не проявляют этот эффект [22, 30, 38].
Поскольку низкие дозы аспирина могут вызывать развитие тяжелых осложнений со стороны ЖКТ [15], возникает вопрос о преимуществах ингибиторов ЦОГ-2 перед "стандартными" НПВП у пациентов, вынужденных принимать низкие дозы аспирина. Однако результаты недавних исследований свидетельствуют о тенденции к снижению частоты, как симптоматических побочных эффектов, так и тяжелых осложнений со стороны ЖКТ на фоне лечения ингибиторами ЦОГ-2 по сравнению со стандартными НПВП [37] (табл. 2).
Таким образом, фармакотерапия боли продолжает оставаться трудным разделом фармакотерапии заболеваний человека. Внедрение ингибиторов ЦОГ-2, с одной стороны, сделало лечение более безопасным, с другой стороны - привлекло внимание к ряду аспектов противовоспалительной и анальгетической терапии НПВП (см. схему 2). Мы надеемся, что новые данные о положительных и отрицательных свойствах НПВП и парацетамола позволят врачам оказывать более квалифицированную помощь пациентам с болями различной природы и избежать ошибок, которые могут привести к нежелательным последствиям для здоровья и даже жизни пациентов.
Литература
- Кукес В. Г., Сычев Д. А. Клиническая фармакология ненаркотических анальгетиков // Клин. фармакол. терапия. - 2002, № 5. - С. 73-78.
- Насонов Е. Л. Фармакотерапия боли: взгляд ревматолога// Консилиум. - 2000. - № 1. - С. 1 - 10.
- Насонов Е. Л. Нестероидные противовоспалительные препараты (Перспективы применения в медицине). - М., Изд-во "Анко", 2000. - 143 с.
- Насонов Е. Л., Цветкова Е. С., Toв H. Л. Селективные ингибиторы циклооксигеназы-2: новые перспективы лечения заболеваний человека // Тер. архив. - 1998. - №5. - С. 8-14.
- Насонов Е. Л. Специфические ингибиторы ЦОГ-2: решенные и нерешенные проблемы // Клин. фармакол. и терапия. - 2000. - №1. - С. 57-64.
- Насонов Е. Л. Анальгетические эффекты нестероидных противовоспалительных препаратов при заболеваниях опорно-двигательного аппарата: баланс эффективности и безопасности // Консилиум. - 2002. - №3(5). - С. 209- 215.
- Abramson S. В. Et Tu, Acetaminofen? // Arthritis Rheum. - 2002. - № 46. - P. 2001-2003.
- Baigent C., Patrono C. Selective cyclohygenase 2 inhibitors, aspirin, and cardiovascular disease // Arthritis Rheum. - 2003. - № 48. - P. 12-20.
- Boers M. NSAIDs and selective COX-2 inhibitors: competition between gastroprotection and cardioprotection // Lancet. - 2001. - Vol. 357. -P. 1222-1223.
- Bombardier C. An evidence-based evaluation of the gastrointestinal safety of coxibs // Am. J. Med. - 2002. - № 89: (suppl.). - P. 3D-9D. 117 Catella-Lawson F., Reilly M. P., Kapoor S. C.et al. Cyclooxige-nase inhibitors and the antiplatelet effects of aspirin// N. Engl. J. Med. - 2002. - Vol. 345. - P. 1809-1817.
- Chandrasekharan N. V., Ни Dai, Lamar Turepu Roos K. et al. COX-3, a cyclooxigenase-1 variant inhibited by acetaminofen and other analgesic/antipyretic drugs: cloning, structure, and expression. PNAS 2002.
- Crofford L. J., Lipsky P. E., Brooks P. et al. Basic biology and clinical application of specific cycloxygenase-2 inhibitors // Arthritis Pheum, 2000. - № 43. - P. 33 157-33 160.
- Cuhan G. C., Willett W. C., Rosner B. et al. Frequency of analgesic use and risk of hypertension in young women // Arch. Intern. Med. - 2002. - № 162. - P. 2204-2208.
- Deny S., Loke Y. K. Risk of gastrointestinal haemorrage with long term use of aspirin // BMJ. - 2000. - № 321. - P. 1183-1187.
- Felson D. T. The verdict favors nonsteroidal anti-inflammatory drugs for the treatment of osteoarthritis and a plea for more evidence on other treatment (editorial) // Arthritis Rheum. - 2001. - № 44. - P. 1477-1480.
- Fitzgerald G. A., Patrono C. The Coxibs, selective inhibitors of cyclooxygenase-2// New Engl. J. Med. - 2001. - Vol. 345. - P. 433-442.
- Fоred C. M., Ejerblad E., Lindblad P. et al. Acetaminofen, aspirin, and chronic renal failure // New Engl. J. Med. - 2001. - № 345. - P. 1801-1808.
- Garcia-Rodriguez L. A. t al. Risk of hospitalisation for upper gastrointestinal tract bleeding associated with Ketorolac, other NSAIDs, calcium antagonists, and other antihypertensive drugd // Arch. Intern. Med. - 1998. - № 158. - P. 33-39.
- Garcia Rodriguez L. A., Hernandez-Diaz S. Risk of upper gastrointestinal complications among users of acetaminofen and nonsteroidal anti-inflammatory drugs // Epidemiology. - 2001. - № 12. - P. 570-576.
- Garcia Rodriguez L. A. The effect of NSAIDs on the risk of coronary heart disease: fusion of clinical pharmalogy and phar-macoepidemiologic data // Clin. Exp. Rheumatol. - 2001. №19 (suppl. 25). - S41-S45.
- Greenberg M., Gottesdiener K., Huntington M. et al. A new cyclooxygenase-2 inhibitor, rofecoxib (VIOOX), did not alter the antiplateled effects of low-dose aspirin in healthy volunteers // J. Clin. Pharm. - 2000. - № 40. - P. 1509-1515.
- Katz W. A. Cyclooxygenase-2 selective inhibitors in the management of acute and perioperative pain// Clev. Clin. J. Med. - 2002. - Vol. 69. - P. SI-65-si-75.
- Konstam M. A., Weir A. R. Current persective on the cardiovascular effects of coxibs // Clev. Clin. J. Med. - 2002 (suppl 1). - SI-47-SI-52.
- Mс Adam B. F., Catella-Lawson E., Mardini I. A. et al. Systemic biosynthesis of prostacyclin by cyclooxigenase (COX)-2: the human pharmacology of a selective inhibitors of COX-2 // PNAS. - 1999. - № 96. - P. 272-277.
- McDonald T. M., Wei L. Effect of ibuprofen on cardioprotec-tive effect of aspirin// Lancet. - 2003. - Vol. 361. - P. 573.
- Menniti-lppolito F. et al. Ketorolak use in outpatients and gastrointestinal hospitalization: a comparison with other non-ster-oidal anti-inflammatory drugs in Italy // Eur. J. Clin. Pharma-col. - 1998. - № 54. - P. 393-397.
- Mukherjee D., Nissen S. E., Topol E. J. Risk of cardiovascular events associated with selective COX-2 inhibitors // JAMA. - 2001. - № 286. - P. 954-959.
- National Institute of Clinical Exellence. Guidlance on the use of cyclo-oxygenase (COX) II selective inhibitors, celecoxib, meloxicam and etodolac for osteoarthritis and rheumatoid arthritis. Technology Apprasial Guidlance - No. 27. London Goverment publication, 2001.
- Ouellett M., Riendeau D., Percival D. A high level of cyclooxygenase-2 inhibitor selectivity is associated with a reduced in-tereference of plateled cyclooxygenase-1 inactivation by aspirin // PNAS. - 2001. - № 98. - P. 14 583-14 588.
- Schoenfeld P. Gastrointestinal safety profile of meloxicam: a methaanalysis and systematic review of randomizes controlled trials // Am. J. Med. - N 107 (6A). - P. 48S-54S.
- Simon L. S., Smolen J. S., Abramson S. B. et al Controversies in COX-2 selective inhibition // J. Rheumatol. - 2002. - № 29. - P. 1501-1510.
- Stampfer D. J., Hankinson S. E., Willett W. C. et al. Nonnar-cotic analgetic use and the risk of hypertension in US women // Hypertension. - 2002. - № 40. - P. 601-603. 35. Strand V., Hochberg M. C. The rick cardiovascular thrombotic events with selective cyclooxygenase-2 inhibitors // Arthritis Rheum. (Arthritis Care&Res). - 2002. - № 47. - P. 349-355.
- Ray W. A., Stein C. M., Hall K. t al. Non-steroidal anti-inflammatory drugs and risk of serious coronary heart disease: an observational cohort study // Lancet: 2002. - Vol. 359. - P. 118-123.
- Trаvers G. et al. Gastroduodenal toxicity of different nonsteroidal anti-inflammatory drugs // Epidemiology. - 1995. - № 6. - P. 49-54.
- Van Solingen R. M., Rosenstein E. D., Mihailescu G. et al. Comparison of the effects of ketoprofen on plateled function in the presence and absence of aspirin // Am. J. Med. - 2001. - № 111. - P. 285-289.
- Weir M. R. Renal effects of nonselective NSAIDs and coxibs // Cleveland Clin. J. Med. - 2002; 69 (supp. 1): SI-53-SI-58.
- White W. В., Faich G., Whelton A. et al. Comparison of thromboembolic events in patients treated with celecoxib, a cyclooxygenase-2 specific inhibitor, versus ibuprofen or di-clofenac // Am. J. Cardiol. - 2002. - № 89. - P. 25-430.






