Нейрохимический анализ и фармакологическая регуляция кортикофугальных механизмов контроля ноцицептивных сигналов в афферентных путях
Экcпеpиментальная и клиничеcкая фаpмакология
В. В. Чурюканов
Кафедра фармакологии лечебного факультета Московской
медицинской академии им. И. М. Сеченова,
Москва, 119881,
ул. Б. Пироговская, 2/6.
Neurochemical analysis and pharmacological regulation of corticofugal mechanisms of nociceptive processing in afferent pathways
V. V. Churukanov
Sechenov Medical Academy, ul. Bol'shaya Pirogovskaya 2/6, Moscow, 119881 Russia
Experimental and clinical data indicate that the cerebral cortex plays an important role in pain perception and endogenous antinociceptive system function.
Moreover, the enhancement of descending inhibitory cortical control may be involved in the mechanisms of analgesic effect of some agents. The present study was designed to investigate the effect of cortical electrical stimulation (as a model of descending inhibitory control) on the behavioral and electrophysiological signs of nociceptive response, elucidate the mechanisms involved therein and evaluate the action of central analgesics (both opioid and non-opioid) on descending cortical control. In acute experiments on cats, the inhibitor y cortical influence upon neuronal activity produced by nociceptive stimuli (electrical stimulation of tooth pulp, C-fibers of afferent somatic nerves, afferent cardiac structures) was most marked after stimulation of the first and second sensory and fronto- orbital areas. In chronic experiments on rats, cortical stimulation reduced behavioral signs of visceral pain (writhing test) and also delayed the development of neuropathic pain syndrome along with lowering its intensity.
-Opioid receptor agonists (morphine, fentanyl) potentiated the inhibitory cortical effect on the evoked neuronal activity. Pentazocine, which has pronounced
-receptor agonist activity, was less effective. Naloxone eliminated the effects of both cortical stimulation and opioid analgesics. Serotonin receptor antagonist methysergide, as well as p-chlorophenylalanine significantly decreased inhibitory cortical control and the effect of opioids. Monoamine re-uptake inhibitors with analgesic properties (imipramine, fluoxetine) potentiated the inhibitory effect of cortical stimulation. Adreno-, dopamine-, acetylcholine-, GABA-receptor agents and antagonists of NMDA receptors had minor or no effect. Among non-narcotic analgesics, the cyclooxygenase inhibitors metamysole and ketorolak increased only moderately the descending cortical control of nociception. Thus, the cerebral cortex is able to control the nociceptive processing in different pain syndromes (somatic, visceral or neuropathic pain). Opioidergic and serotonergic systems play the key role in this control. Action through the cortical descending control is likely to be one of the components of the analgesic effect exerted by opioids and some other central analgesics.
1. Введение
Клинические наблюдения и данные экспериментов свидетельствуют о том, что кора большого мозга (КБМ) играет существенную роль в восприятии и регулировании боли [см. обзор 21]. Основные аргументы в пользу участия коры в этих процессах сводятся к следующему. Повреждение некоторых участков коры сопровождается гипо- или анальгезией [31, 32, 38], при электрической стимуляции ряда кортикальных полей во время хирурги- ческих операций у пациентов возникают болевые ощущения или, наоборот, понижение болевой чувствительности [1]. В условиях эксперимента удаление или разрушение некоторых зон коры вызывает у животных изменение поведенческих и вегетативных ноцицептивных реакций: ослабление или усиление [3]. Электрическая стимуляция КБМ в экспериментах угнетает поведен- ческие ноцицептивные реакции [18], а в острых опытах - снижает ответы нейронов спинного мозга и надсегментарных структур на повреждающее раздражение [2, 7, 11]. В коре обнаружены нейроны, реагирующие на ноцицептивную стимуляцию [22 - 24]. Исследования с использованием позитронной эмиссионной томографии в комбинации с методом ядерно-магнитного резонанса выявили существенные изменения кровотока и локального метаболизма в полях коры при ноцицептивных воздействиях[20, 33]. Целью настоящего исследования явилось изучение участия системы кортикального контроля ноцицепции в механизмах действия болеутоляющих средств. Кроме того, предпринята попытка установить роль КБМ в функционировании эндогенной антиноцицептивной системы, а также выявить основные нейрохимические механизмы ингибирующих кортикофугальных влияний на передачу ноцицептивных сигналов.
2. Основные методы исследования Основная часть экспериментов была выполнена с использованием электрофизиологических методов исследования.
В качестве модели нисходящего кортикального контроля применяли электрическое раздражение КБМ.
Острые эксперименты выполнены на кошках в условиях общей анестезии хлоралозой и дополнительного обездвиживания флакседилом. Кондиционирующее раздражение коры осуществляли посредством биполярного электрода. Использовали серии импульсов и одиночные стимулы. Согласно данным литературы, кора, как и другие элементы эндогенной антиноцицептивной системы, может оказывать двоякое влияние на вызванную активность нейронов: стимулирующее или угнетающее [11, 41]. Аналогичные результаты были получены и в наших экспериментах (табл. 1). В последующем в соответствии с целями проводимого исследования анализу были подвергнуты данные тех опытов, где регистрировали угнетающее влияние электрической стимуляции КБМ на биоэлектрическую активность субкортикальных и сегментарных структур. Подбор параметров стимуляции коры у каждого животного проводили индивидуально таким образом, чтобы амплитуда вызванных потенциалов или характеристики других биоэлектрических реакций при кондиционирующей стимуляции коры снижались до 70 - 80 % от исходных данных.
Таблица 1. Влияние электрической стимуляции коры большого мозга на активность нейронов таламических ядер.
Структура |
Количество исследованных нейронов |
Реакция нейронов на стимуляцию коры 1 |
|||
угнетение спонтанной активности |
усиление спонтанной активности |
угнетение вызванной активности 2 |
без эффекта |
||
Парафасцикулярный комплекс |
187 | 89(48 %) | 11(5 %) | 47(25 %) | 87(47 %) |
Задняя группа ядер |
149 | 67(45 %) | 10(5 %) | 44(29 %) | 72(48 %) |
| Примечание. 1 - серии электрических импульсов наносили на 2-ю зону соматовисцеральной чувствительности. 2 - активность вызвана электрической стимуляцией седалищного нерва |
|||||
Тестирующей стимуляции (ноцицептивное раздражение) подвергали афферентные соматические нервы, а также пульпу зуба. Нервы раздражали одиночными супрамаксимальными электрическими стимулами с интенсивностью, достаточной для возбуждения тонких миелинизированных волокон А-дельта и безмиелиновых С-волокон.
Вызванные потенциалы и активность отдельных нейронов при стимуляции соматических нервов регистрировали в надсегментарных структурах, участвующих в процессах восприятия боли: вентробазальном комплексе и задней группе ядер таламуса, медиальных и интраламинарных ядрах (медиодорзальном, центральном медиальном, центральном латеральном, парафасцикулярном ядрах, срединном центре), а также на уровне продолговатого мозга в n.gracilis.
При изучении кортикофугальных влияний на передачу ноцицептивных импульсов на сегментарном уровне регистрировали активность отдельных нейронов заднего рога на уровне L6 - 7 в ответ на супрамаксимальную электри ческую стимуляцию поверхностного малоберцового нерва и общего ствола седалищного нерва. По функциональной характеристике большинство изученных нейронов относилось к типу мультирецептивных, т.е. активировались разномодальными стимулами, в том числе ноцицептивными.
Эти нейроны располагались в IV - V пластинах заднего рога. По сравнению со специфическими ноцицептивными нейронами, локализующимися преимущественно в 1-й пластине, активность этих нейронов в большей степени регулируется нисходящими влияниями из супрасегментарных структур [5].
При тестирующей стимуляции пульпы зуба вызванные потенциалы и активность отдельных нейронов регистрировали в ядрах тригеминального комплекса: главном сенсорном, оральном, интерполярном, каудальном.
Для количественной оценки кортикофугальных влияний и эффектов веществ сопоставляли исходную амплитуду вызванных потенциалов с теми же параметрами после соответствующих манипуляций и выражали в процентах.
Показатели спонтанной и вызванной активности отдельных нейронов в виде частоты спайковых разрядов при кортикальной стимуляции, а затем после введения препаратов сравнивали с исходными величинами у данного животного и выражали в процентах. В ряде экспериментов проводили анализ постстимульных гистограмм.
Результаты экспериментов подвергнуты статистической обработке посредством специальных компьютерных программ с использованием t-критерия Стьюдента и вариантного анализа (ANOVA).
Условия содержания животных и экспериментов соответствовали требованиям Международной организации по изучению боли [42].
3. Влияние электрической стимуляции коры большого мозга на электрофизиологи ческие и поведенческие признаки ноцицептивных реакций
3.1. Модели соматической боли Представлялось целесообразным в первую очередь выявить зоны КБМ, оказывающие наиболее выраженное влияние на передачу ноцицептивных импульсов на сегментарном и супраспинальном уровнях. С этой целью сопоставляли выраженность снижения амплитуды вызванных потенциалов и степень подавления активности отдельных нейронов, а также количество структур, в которых эти эффекты регистрируются, при электрической стимуляции разных участков коры. Наиболее выраженные изменения вызванной активности (подавление на 30 - 45 %) в большинстве исследованных структур наблюдали при стимуляции 2-й зоны соматовисцеральной чувствительности и фронто-орбитальной коры. Менее эффективной была стимуляция 1-й зоны соматовисцеральной чувствительности и некоторых участков зрительной коры. Стимуляция других участков была неэффективна либо изменения были незначительны. В пределах зон коры, стимуляция которых вызывала угнетение переда чи возбуждения, выделяли участки, наиболее эффективные применительно к определенным субкортикальным структурам. Как и в случае тестирующей стимуляции соматических нервов, структурами, наиболее эффективно угнетающими вызванную активность в ядрах тригеминального комплекса при раздражении пульпы зуба, оказались 2-я зона соматовисцеральной чувствительности и фронто-орбитальная кора.
На сегментарном уровне кондиционирующая стимуляция фронто-орбитальной коры и 2-й зоны соматовисцеральной чувствительности вызывала подавление вызванных разрядов у исследованных нейронов на 25 - 30 %. Стимуляция других зон коры была менее эффективна. В специальной серии экспериментов проведена сравнительная оценка кортикальных влияний (электрическая стимуляция 2-й зоны соматовисцеральной чувствительности, фронто-орбитальной коры) и эффектов стимуляции ключевых структур эндогенной антиноцицептивной системы мозга: околоводопроводного серого вещества, ядер шва. Оказалось, что кортикофугальные влияния на нейрональную активность в ядрах тройничного нерва, вызванную раздражением пульпы зуба, по выраженности сопоставимы с эффектами, наблюдающимися при электри ческой стимуляции указанных выше структур среднего и продолговатого мозга.
Известно существование кортикобульбарных и кортикоспинальных проекций в ядра дорзальных столбов, тригеминальный комплекс и задний рог спинного мозга [4, 5, 7]. Кроме того, в электрофизиологических экспериментах продемонстрированы угнетающее и облегчающее влияния стимуляции КБМ на активность нейронов в указанных структурах [11, 41]. Методом внутрикортикальной микростимуляции показано, что наиболее выраженное угнетение активности спинальных нейронов, вызванной ноцицептивным и неноцицептивным воздействием, достигается при электрическом раздражении 3-го и особенно 5-го и 6-го слоев [7], где расположены тела пирамидных нейронов, чьи аксоны формируют кортикоспинальные пути. При этом наблюдается деполяризация перви чных афферентов [7], что является признаком усиления пресинаптического торможения. Однако помимо прямого влияния КБМ на активность сегментарных структур, участвующих в процессах ноцицепции, существуют и другие механизмы. Так, имеются анатомические и электрофизиологические доказательства связей КБМ со структурами среднего (околоводопроводное серое вещество и др.) и продолговатого (ядра шва и др.) мозга [5, 13, 14], играющими важную роль в функционировании эндогенной антиноцицептивной системы. Указанные структуры, в свою очередь, контролируют ноцицептивную импульсацию посредством нисходящих влияний [40], а также за счет воздействия в ростральном направлении [29].
3.2. Модели висцеральной боли
Показано, что в характере соматической и висцеральной боли и механизмах их формирования имеются определенные различия [16, 17, 30]. Для исследования кортикальных влияний на проведение висцеральных ноцицептивных импульсов были выполнены две серии экспериментов.
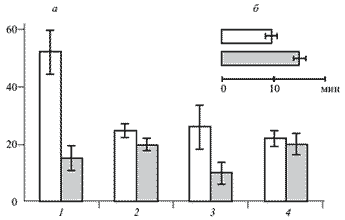
Рис. 1. Влияние электрической стимуляции коры большого мозга крыс на развитие и течение синдрома "корчей".
Светлые столбики-контрольная группа животных (без электродов для стимуляции коры); серые-основная группа животных (с имплантированными электродами). а - количество корчей за определенный отрезок времени: 1 - в течение 30 мин после инъекции уксусной кислоты; стимуляция коры в основной группе; 2 - 31 - 40 мин; в основной группе стимуляцию коры не проводили; 3 - 41 - 50 мин; стимуляция коры в основной группе; 4 - 51 - 60 мин; в основной группе стимуляцию коры не проводили. б - латентный период корчей.
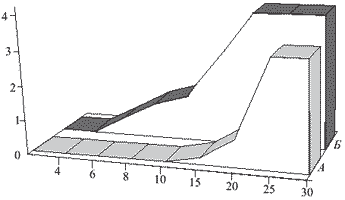
Рис. 2. Влияние электрической стимуляции коры большого мозга на интенсивность болевого синдрома у крыс после пересечения седалищного нерва. А-группа животных, которым проводили сеансы стимуляции коры; Б -контрольная группа животных. По оси ординат-интенсивность болевого синдрома в баллах, по оси абсцисс - время (сутки) после пересе чения седалищного нерва.
В серии электрофизиологических экспериментов, спланированных по описанной выше схеме, в качестве источника висцеральных ноцицептивных сигналов была избрана зона синусного узла (ЗСУ) - участок миокарда, где, помимо клеток водителя ритма и аппарата эфферентных симпатических влияний, сосредоточены афферентные сплетения. Афферентные сигналы, в том числе ноцицептивные, направляются от сердца в ЦНС в основном по двум группам волокон [27]. Первая в составе ветвей блуждающего нерва достигает ядра солитарного тракта в продолговатом мозге. Волокна 2-й группы вступают в спинной мозг в составе задних корешков (Т1 - Т9) и имеют прямой или опосредованный контакт с нейронами 5-го слоя в заднем роге. Электрическая стимуляция ЗСУ генерирует залп афферентных импульсов с ноцицептивной составляющей. В пользу последнего свидетельствует то обстоятельство, что вызванные потенциалы максимальной амплитуды на раздражение ЗСУ регистрируются, как правило, при параметрах стимуляции, достаточных для возникновения вегетативных компонентов ноцицептивной реакции - расширение зрачка, повышение артериального давления.
Установлено, что при кондиционирующей стимуляции КБМ наиболее значительные изменения потенциалов, вызванных ноцицептивным раздражение миокарда, наблюдаются в заднем гипоталамусе, таламических неспецифи ческих ядрах, околоводопроводном сером веществе. Более выраженный эффект отмечается при стимуляции 1-й и 2-й зон соматовисцеральной чувствительности, ассоциативных полей в области крестовидной борозды и передней части средней супрасильвиевой извилины.
В качестве модели поведенческой ноцицептивной реакции висцерального генеза использовали метод "кор- чей" у крыс, когда признаки боли обусловлены химическим раздражением брюшины. Животным вводили внутрибрюшинно раствор уксусной кислоты. Оценивали латентный период возникновения реакции, количество "корчей" за определенный отрезок времени, а также их выраженность. Для электрической стимуляции коры животным предварительно имплантировали электроды в зоне соматовисцеральной чувствительности одного или обоих полушарий.
Электрическая стимуляция коры, начатая тотчас после введения уксусной кислоты, в 2 - 2,5 раза пролонгировала латентный период возникновения "корчей" (рис. 1). В последующем количество "корчей" в основной группе животных составляло 30 - 40 % по сравнению с контрольной группой (без стимуляции коры).
При стимуляции коры снижалась также интенсивность отдельных "корчей" - они становились короче и менее выраженными. Сходный эффект наблюдался как при билатеральной, так и унилатеральной стимуляции коры. По прекращении электрической стимуляции антиноцицептивный эффект сохранялся в течение 5 - 10 мин.
Блокатор опиоидных рецепторов налоксон не изменял антиноцицептивный эффект стимуляции КБМ, а также не влиял на течение "корчей" у контрольной группы животных. Между тем, в электрофизиологических экспериментах блокада опиоидных рецепторов налоксоном полностью выключает тормозный эффект стимуляции коры с соматическим или висцеральным тестирующим раздражением.
3.3. Модель нейропатической боли
Известны значительные различия в механизмах возникновения острой боли и хронических болевых синдромов, в том числе нейрогенных [15]. В связи с этим было исследовано влияние электрической стимуляции КБМ на развитие и выраженность нейрогенного болевого синдрома, возникающего у крыс вследствие пересечения седалищного нерва [36]. Для его воспроизведения у крыс пересекали седалищный нерв, его центральный отрезок помещали в полиэтиленовую капсулу. Развитие синдрома оценивали по изменению поведения животных, появлению признаков аутотомий на оперированной лапе и развитию гипералгезии. Интенсивность ноцицептивной реакции определяли, используя шкалу в баллах. Для стимуляции соматосенсорной коры имплантировали электроды в контралатеральное полушарие по отношению к лапе с пересеченным нервом. Стимуляцию коры проводили на протяжении 7 дней ежедневно, начиная с 1-го дня после пересечения нервного ствола, в течение 5 мин. Наблюдение за динамикой болевого синдрома у этих животных установило замедление его развития: синдром не развивался на протяжении 7 дней стимуляции и в последующие 6 дней после ее прекращения. В контрольной группе к этому сроку (13-й день эксперимента) аутотомии отме- чались у 90 % животных. Стимуляция коры уменьшала также интенсивность болевого синдрома (рис. 2).
Таким образом, система нисходящего кортикального контроля эффективно вмешивается в процессы ноцицепции в условиях острых (соматических и висцеральных) и хронических болевых синдромов.

Рис. 3. Влияние морфина на активность мультирецептивных нейронов (n = 6) в заднем роге спинного мозга (5-й слой) и эффект кондиционирующей стимуляции коры большого мозга, в процентах.
Здесь и на рис. 4: А-спонтанная активность. Б-активность, вызванная стимуляцией седалищного нерва. 1-исходная активность; 2-активность после введения морфина (0,5 мг кг в вену); 3 - активность в условиях стимуляции коры; 4 - активность в условиях стимуляции коры на фоне морфина. Звездочка-отличия статистически значимы от данных до введения вещества, p < 0,05.
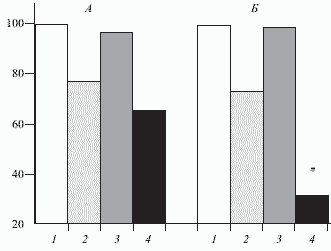
Рис. 4. Влияние фентанила (0,005 мг кг) на активность нейронов (n = 8) каудального ядра тригеминального комплекса и эффект кондиционирующей стимуляции коры большого мозга, в процентах. Обозначения те же, что на рис. 3.
4. Нейрохимический анализ нисходящих влияний коры большого мозга на переда- чу ноцицептивных сигналов; эффект опиоидов
Нейрохимический анализ нисходящих кортикальных влияний проведен с использованием веществ, влияющих на опиоидергические, адренергические, дофаминергические, серотонинергические, холинергические и ГАМКерги ческие механизмы. Выбор указанных нейромедиаторных систем обусловлен их участием в формировании болевых синдромов разного происхождения, а также функционировании эндогенной антиноцицептивной системы [37]. Результаты данной серии экспериментов представлены в табл. 2. Наиболее выраженные изменения в системе кортикального контроля наблюдались в случае воздействия на опиоидергические механизмы. Так, агонист опиоидных ч-рецепторов морфин (0,5 - 1 мг/кг в вену) значительно усиливал (на 50 % и более) ингибирующий эффект кортикальной стимуляции в отношении потенциалов, вызванных электрическим раздражением соматических нервов, в вентробазальном комплексе и задней группе ядер таламуса, медиальных и интраламинарных ядрах таламуса, а также в n.gracilis. Аналогич- ный эффект наблюдался при регистрации потенциалов, вызванных стимуляцией пульпы зуба, в ядрах тригеминального комплекса.
Таблица 2. Нейрохимический анализ нисходящих ингибирующих влияний коры большого мозга на передачу ноцицептивных сигналов в афферентных путях
Опиоидергическая система |
|
| Стимуляция μ -рецепторов морфин, фентанил |
↑↑↑ |
| Стимуляция k-рецепторов пентазоцин |
↑↑ |
| Ингибирование инактивации энкефалинов тиорфан |
↑ |
| Блокирование рецепторов налоксон |
↓↓↓ |
Серотонинергическая система |
|
| Стимуляция рецепторов квипазин |
↑ |
| Угнетенне нейронального захвата
медиатора флуоксетин |
↑↑ |
| Ингибирование синтеза медиатора п-хлорфенилаланин |
↓↓ |
| Блокирование рецепторов метисергид |
↓↓ |
Адренергическая система |
|
| Стимуляция рецепторов α2 клофелин β изадрин |
0 |
| Блокирование рецепторов α1 празозин α2 йохимбин α1α2 фентоламин β анаприлин |
0 |
Дофаминергическая система |
|
| Стимуляция рецепторов апоморфин |
0 |
| Блокирование рецепторов галоперидол |
0 |
Холинергическая система |
|
| Антихолинэстеразные средства физостигмин |
0 |
| Блокирование м-холинорецепторов скополамин |
0 |
ГАМК-ергическая система |
|
| Стимуляция рецепторов ГАМКA THIP ГАМКB баклофен |
↑↓ ↑ |
| Блокирование рецепторов ГАМКA бикукуллин ГАМКB факлофен |
↑↑ 0 |
Система возбуждающих аминокислот |
|
| Антагонизм с NMDA-рецепторами дизоцилпин |
0 |
| Примечание. Здесь и в
табл. 2 и 3: ↑ - усиление; ↓ - ослабление; 0 - отсутствие эффекта; действие: | - слабое; || - умеренное; ||| - выраженное. |
|
В случае микроэлектродной регистрации активности отдельных нейронов в указанных структурах морфин усиливал эффект кортикальной стимуляции на 15 - 85 %. Морфин усиливал также тормозные кортикофугальные влияния на активность мультирецептивных нейронов в заднем роге спинного мозга (рис. 3). Существенно, что в использованных дозах морфин не оказывал непосредственного влияния на амплитуду вызванных потенциалов или спонтанную активность отдельных нейронов; мало изменялась вызванная нейрональная активность. Налоксон прекращал эффект морфина. Фентанил (0,001 - 0,01 мг/кг внутривенно) оказывал действие, аналоги чное морфину (рис. 4).
В отличие от морфина эффект пентазоцина (3 - 5 мг/кг в вену) был менее выраженным: угнетающее влияние кортикальной стимуляции на вызванные потенциалы и активность отдельных нейронов в большинстве экспериментов увеличивалось на 10 - 45 %. Налоксон прекращал эффект пентазоцина. В 20 % всех случаев регистрации активности отдельных нейронов (на уровне спинного мозга, в супраспинальных структурах) при стимуляции соматических нервов или пульпы зуба не отмечалось усиления кортикофугальных влияний после введения пентазоцина.
Полученные результаты свидетельствуют о том, что агонисты опиоидных ч-рецепторов (морфин, фентанил) значительно усиливают тормозные кортикофугальные влияния на проведение соматических ноцицептивных импульсов. В то же время пентазоцин, в чьем спектре ре цепторной активности преобладает взаимодействие с к-рецепторами, оказывает существенно меньшее влияние на кортикофугальные механизмы.
Одним из компонентов в механизме болеутоляющего действия морфина и других опиоидных анальгетиков является взаимодействие последних с опиоидными рецепторами на пресинаптической мембране первичных безмиелиновых афферентов спинного мозга [12]. В результате уменьшается выделение медиаторов ноцицептивных сигналов (субстанция Р, глутамат и др.). Возможно, в основе усиления кортикального торможения под влиянием опиоидных анальгетиков лежит взаимодействие на уровне первичных афферентов. Кроме того, морфин, возбуждая опиоидные рецепторы на постсинаптической мембране интернейронов заднего рога, способствует гиперполяризации мембраны и подавляет их активность [12, 13]. Опиоидные анальгетики усиливают нисходящие тормозные влияния структур среднего и продолговатого мозга на передачу ноцицептивных импульсов на сегментарном уровне [12]. Возникающий при стимуляции коры залп импульсов, достигая околоводопроводного серого вещества, ядер шва и других структур в условиях действия на них опиоидных анальгетиков, может значительно усилить нисходящие влияния указанных образований. Наконец, показано наличие в коре опиоидных рецепторов, преимущественно подтипа [39]. При аппликации на кору агонистов опиоидных рецепторов угнетается вызванная биоэлектрическая активность сегментарного аппарата и некоторых подкорковых образований [19]. При введении опиоидных анальгетиков может существенно увеличиваться активность кортикальных структур, генерирующих нисходящие тормозные импульсы.
Блокирование серотониновых рецепторов (метисергид) значительно уменьшало тормозный эффект кортикальной стимуляции, в то время как стимуляция серотонинерги ческой передачи в ЦНС за счет нарушения нейронального захвата медиатора (флуоксетин) умеренно усиливала ингибирующие кортикофугальные механизмы. Использованные методические приемы не выявили существенную значимость адренергических, дофаминерги ческих и холинергических механизмов в реализации эффекта электрической стимуляции КБМ.
При использовании ГАМК-ергических веществ показана разная направленность изменений системы кортикального контроля в случае стимуляции ГАМКA-рецепторов (THIP): усиление тормозных влияний на вызванную активность большинства мультирецептивных нейронов и ослабление - на активность специфических ноцицептивных нейронов.
5. Нейрохимический анализ влияния опиоидных анальгетиков на нисходящие кортикальные механизмы
При анализе действия морфина, фентанила, пентазоцина получены сходные результаты.
Так, адренергические и дофаминергические вещества (фентоламин, йохимбин, клофелин, анаприлин, изадрин, галоперидол, апоморфин) не оказывали существенного влияния на эффект опиоидных анальгетиков в отношении кортикофугальных влияний. Блокатор серотониновых рецепторов метисергид уменьшал эффект опиоидных анальгетиков при тестирующем раздражении соматических нервов и пульпы зуба во всех исследованных структурах как при регистрации вызванных потенциалов, так и при записи активности отдельных нейронов. Флуоксетин-ингибитор нейронального захвата серотонина-усиливал эффект опиоидов при микроэлектродной регистрации нейрональной активности.
Скополамин и физостигмин не оказывали существенного влияния на эффект опиоидов по всем исследованным параметрам.
THIP, баклофен, бикукуллин усиливали эффект опиоидов на кортикофугальный тормозный контроль при регистрации активности у части нейронов на уровне спинного - мозга и в супраспинальных структурах. Факлофен не оказывал существенного влияния на изучаемые процессы.
Таким образом, в реализации эффекта усиления кортикофугального торможения ноцицептивной импульсации под влиянием опиоидных анальгетиков принимают участие серотонинергические механизмы, чьим анатомо-физиологи ческим субстратом является система "околоводопроводное серое вещество - ядра шва". Определенную роль при этом играет система ГАМК.
Таблица 3. Нейрохимический анализ влияния опиоидных анальгетиков на нисходящие кортикальные механизмы контроля ноцицептивных сигналов в афферентных путях
Опиоидергическая система |
|
| Блокирование рецепторов налоксон |
↓↓↓ |
Серотонинергическая система |
|
| Стимуляция рецепторов квипазин |
0 |
| Угнетенне нейронального захвата
медиатора флуоксетин |
↑↑ |
| Ингибирование синтеза медиатора п-хлорфенилаланин |
↓↓ |
| Блокирование рецепторов метисергид |
↓↓ |
Адренергическая система |
|
| Стимуляция рецепторов α2 клофелин β изадрин |
0 0 0 0 |
| Блокирование рецепторов α1 празозин α2 йохимбин α1α2 фентоламин β анаприлин |
0 0 |
Дофаминергическая система |
|
| Стимуляция рецепторов апоморфин |
0 |
| Блокирование рецепторов галоперидол |
0 |
Холинергическая система |
|
| Антихолинэстеразные средства физостигмин |
0 |
| Блокирование м-холинорецепторов скополамин |
0 |
ГАМК-ергическая система |
|
| Стимуляция рецепторов ГАМКA THIP ГАМКB баклофен |
0 0 |
| Блокирование рецепторов ГАМКA бикукуллин ГАМКB факлофен |
↑↑ 0 |
Система возбуждающих аминокислот |
|
| Антагонизм с NMDA-рецепторами дизоцилпин |
0 |
6. Влияние неопиоидных анальгетиков на нисходящие кортикальные механизмы
Несомненный интерес представляло исследование влияния на нисходящие кортикальные механизмы неопиоидных анальгетиков центрального действия и других веществ, проявляющих болеутоляющие свойства (табл. 4).
Таблица 4. Влияние анальгетиков и веществ с болеутоляющими свойствами на нисходящий кортикальный контроль ноцицептивных сигналов в афферентных путях
| Опиоидные анальгетики
морфин, фентанил пентазоцин |
↑↑↑ ↑↑ |
| Блокаторы натриевых каналов (противоэпилепти
ческие средства)
карбамазепин, дифенин |
0 |
| Ингибиторы нейронального захвата моноаминов
(антидепрессанты)
имизин, флуоксетин |
↑↑ |
| α2 - Адреномиметики
клофелин |
0 |
| Агонисты ГАМКB-рецепторов
баклофен |
↑ |
| Антагонисты NMDA-рецепторов
кетамин |
0 |
| Ненаркотические анальгетики (ингибиторы
ЦОГ)
анальгин, кеторолак парацетамол |
↑↑ 0 |
Из группы ненаркотических анальгетиков для исследования были выбраны анальгин, кеторолак и парацетамол.
В результате проведенных экспериментов установлено, что анальгин (20 - 60 мг кг в вену) усиливает (на 10 - 20 %) угнетающий эффект кортикальной стимуляции в отношении потенциалов, вызванных электрическим раздражением соматических нервов, в вентробазальном комплексе и задней группе ядер таламуса, медиальных и интраламинарных ядрах таламуса. Аналогич- ный эффект наблюдается при регистрации потенциалов, вызванных раздражением пульпы зуба, в ядрах тригеминального комплекса. Потенциалы в n.gracilis не изменялись. В случае микроэлектродной регистрации биоэлектри- ческой активности в указанных структурах при раздражении соматических нервов или пульпы зуба анальгин усиливал эффект кортикальной стимуляции па 10 - 30 % у 60 % исследованных нейронов. Анальгин усиливал также тормозные кортикофугальные влияния на активность мультирецептивных и специфических ноцицептивных нейронов в заднем роге спинного мозга (табл. 5).
Таблица 5. Влияние анальгина на активность мультирецептивных нейронов в заднем роге спинного мозга (5-ый слой) и эффект кондиционирующей электрической стимуляции коры большого мозга, в процентах (М±м)
| Активность нейронов | До введения вещества | Анальгин 25 мг/кг (n = 6) |
| Спонтанная | 100 | 95,4 ± 3,8 |
| Вызванная стимуляцией седалищного нерва | 100 | 96,2± 5,2 |
| Спонтанная в условиях стимуляции коры | 83,5 ± 3,4 | 79,1± 3,5 |
| Вызванная в условиях стимуляции коры | 73,5 ± 3,1 | 56,8 ± 2,4 * |
| Примечание. *-отличия статистически значимы от данных до введения веществ, p < 0,05. | ||
В использованных дозах анальгин не оказывал непосредственного влияния (в экспериментах без стимуляции КБМ) на амплитуду биопотенциалов или спонтанную и вызванную активность отдельных нейронов. Налоксон не снимал эффект анальгина.
В отличие от анальгина, кеторолак (1 - 5 мг кг в вену) мало изменял угнетающий эффект кортикальной стимуляции в отношении вызванных потенциалов в субкортикальных структурах, в том числе в тригеминальном комплексе. В 65 % всех случаев регистрации активности отдельных нейронов (в заднем роге спинного мозга и супраспинальных структурах) при стимуляции соматических нервов после введения кеторолака не отмечалось усиления кортикофугальных влияний. Эффект кеторолака на процессы в тригеминальном комплексе при микроэлектродной регистрации нейрональной активности был аналогичен эффекту анальгина.
Парацетамол в дозах до 100 мг/кг не оказывал влияния на эффекты электрической стимуляции КБМ. В настоящее время возникновение болеутоляющего эффекта ненаркотических анальгетиков анальгина, кеторолака, парацетамола связывают в основном с центральным действием перечисленных веществ [6, 8, 25, 26].
Анальгин и кеторолак, в отличие от ацетилсалициловой кислоты и других нестероидных противовоспалительных средств, сравнительно мало влияют на синтез простагландинов в периферических тканях. У парацетамола данный эффект практически отсутствует. В то же время эти вещества, угнетая циклооксигеназу в ЦНС, уменьшают содержание простагландинов в спинном и головном мозге.
Кроме того, имеются данные о влиянии ненаркотических анальгетиков на процессы в ЦНС, протекающие с участием окиси азота.
Применительно к полученным в настоящем исследовании сведениям об усилении кортикофугальных механизмов под влиянием анальгина и кеторолака следует отметить, что в литературе имеются данные о том, что анальгин усиливает нисходящие тормозные влияния структур околоводопроводного серого вещества и ядер шва на течение поведенческих ноцицептивных реакций [10].
Вещества центрального действия, обладающие неопиоидной анальгетической активностью, - блокаторы натриевых каналов (карбамазепин, дифенин), антагонист NMDA-рецепторов кетамин, 2-адреномиметик клофелин, агонист ГАМКB-рецепторов баклофен - не изменяли существенно кортикофугальные влияния. Более выраженным оказалось действие антидепрессантов - ингибиторов нейронального захвата моноаминов - имизина и флуоксетина. Усиление процессов кортикального торможения под влиянием последних является, по-видимому, результатом стимуляции серотонинергической переда чи на сегментарном уровне.
7. Заключение
Исследования механизмов боли в 70 - 80-е годы позволили сформировать представление об эндогенной антиноцицептивной системе мозга [см. обзоры 5, 37]. Эта система включает прежде всего сегментарные структуры, образования продолговатого (ядра шва и др.) и среднего мозга (околоводопроводное серое вещество), некоторые таламические ядра, гипоталамус. Были получены данные об участии коры в функционировании этой системы [21]. Концепция эндогенной ноцицептивной системы в свое время послужила основой для объяснения механизма действия опиоидных анальгетиков [12].
Результаты настоящего исследования на разных моделях болевых синдромов (соматическая, висцеральная, нейропатическая боль) свидетельствуют о весьма существенной роли коры большого мозга в регулировании процессов ноцицепции. Показано, что нисходящий кортикальный контроль ноцицепции осуществляется в первую очередь посредством опиоидергической и серотонинерги ческой нейромедиаторных систем.
Усиление кортикального контроля боли под влиянием опиоидных анальгетиков сопоставимо с воздействием последних на систему "околоводопроводное серое вещество - ядра шва". Эффект антидепрессантов - ингибиторов нейроналыюго захвата моноаминов и некоторых ненаркотических анальгетиков на процессы кортикального контроля ноцицепции может быть компонентом в механизме их болеутоляющего действия.
Полученные данные, помимо теоретического аспекта исследования боли и анальгезии, представляют практи- ческий интерес в свете сообщений об эффективности электрической стимуляции коры при лечении нейропати- ческих и центральных болевых синдромов [9, 28, 34, 35].
Литература
1. D. Albe-Fessard, K. J. Berkley, L. Kruger, et al., Diencephalic mechanisms of pain sensation, Brain Res. Reviews, 9, 217 - 296 (1985).
2. E. Andersen, Brain Res., 375, 30 - 36 (1986).
3. K. J. Berkley and R. Palmer, Exp. Brain Res., 20, 363 - 374 (1974).
4. J.-M. Besson, Supraspinal modulation of the segemental transmission of pain. In: Kosterlitz and Terenius L. Y. (Eds.), Pain and Society, Weinheim (1980), pp. 161 - 182.
5. J.-M. Besson, G. Guilbaud, M. Abdelmoumene, and A. Chauch, J. Physiol., Paris, 78, 7 - 107 (1982).
6. R. Bjorkman, K. M. Hallman, J. Hedner, et al., Acetaminophen blocks spinal hyperalgesia induced by NMDA and substance P. Pain, 57, 259 - 264 (1994).
7. A. G. Brown, J. D. Coulter, P. K. Rose, et al., J. Physiol., 264, 1 - 16 (1977).
8. M. Buckley and R. Brogden, Drugs, 39, 86 - 109 (1990).
9. S. Canavero and K. Bonicalzi, J. Neurosurg., 83, 1117 (1995).
10. К.-H. Carlsson, J. Helmreich, and J. Jurna, Activation from the Periaqueductal Grey Matter mediates Central Analgesic Effect of Metamizol (Dipyrone), Pain, 27, 373 - 390 (1986).
11. J. D. Coulter, R. A. Maunz, and W. D. Willis, Effects of stimulation of sensorimotor cortex on primate spinothalamic neurons, 65, 351 - 356 (1974).
12. A. H. Dickenson, Where and how do opioids act? G. F. Gebhart, D. L. Hammond, and T. S. Jensen (Eds.), Proceedings of Нейрохимический анализ и фармакологическая регуляция кортикофугальных механизмов the 7th World Congress on Pain. Progress in pain research and management, Vol. 2 (1994), pp. 525 - 552.
13. A. W. Duggan, Pharmacology of descending control systems. Phyl. Trans. R. Soc. bond, B, 308, 375 - 391 (1985).
14. H. L. Fields, Pain, New York McGraw-Hill Book Company (1987).
15. H. L. Fields and M. C. Rowbotham, Multiple Mechanisms of Neuropathic Pain: a Clinical Perspective. In: T. S. Gebhart, D. L. Hammond, and T. S. Jensen (Eds.), Proceedings of the 7th World Congress on Pain, IASP Press, Seattle (1994), pp. 437 - 454.
16. G. F. Gebhart and T. J. Ness, Mechanisms of visceral pain. In: M. R. Bond, J. E. Charlton, and C. J. Woolf (Eds.), Proceedings of the VI-th World Congress on Pain, Elsevier Science Publishers BV (1991a).
17. G. F. Gebhart and T. J. Ness, Can. J. Physiol. Pharmacol., 69, 627 - 634 (1991b).
18. S. G. P. Hardy, Brain Res, 339, 281 - 284 (1985).
19. A. Hernandez, S. Neira, and R. Soto-Moyano, Europ. J. Pharmacol., 115, 305 - 308 (1985).
20. A. K. P. Jones and S. W. G. Derbyshire, Positron emission tomography (PET) as a tool for understanding the cerebral processing of pain, in: J. Boivie, P. Hansen, and U. Lindblom (Eds.), Touch, temperature and pain in health and disease. Progress in pain research and management, Vol. 3, IASP Press, Seattle (1994), pp. 154 - 172.
21. D. R. Kenshalo andW. D. Willis, The role of the cerebral cortex in pain sensation, E. G. Jones, A. Peters (Eds.), New York (1989), pp. 158 - 203.
22. Y. Lamour, J. C. Wilier, and G. Guilbaud, Neuronal responses to noxious stimulation in rat somatosensory cortex, Neurosci. Lett., 29, 35 - 40 (1982).
23. Y. Lamour, G. Guilbaud, and J. C. Wilier, Rat somatosensory cortex: II. Laminar and columnar organisation of noxious and non-noxious inputs, Exp. Brain Res., 49, 46 - 54 (1983a).
24. Y. Lamour, J. C. Wilier, and G. Guilbaud, Exp. Brain Res., 49, 35 - 45 (1983).
25. E. Yu. Lemina and V. V. Churukanov, Exp. Clin. Pharmacol., 58, 59 - 62 (1995).
26. K. McCormack, Pain, 59, 9 - 43 (1994).
27. S. T. Meller and G. F. Gebhart, Neurosci., 48, 501 - 524 (1992).
28. B. A. Meyerson, U. Lindblom, В. Linderoth, D. Lind, and P. Herregodt, Acta Neurochir. suppl., 58, 150 (1993).
29. M. M. Morgan, J.-H. Sohn, and J. C. Liebeskind, Brain Res., 502, 61 - 66 (1989).
30. T. J. Ness and G. F., Gebhart, Pain, 41, 167 - 234 (1990).
31. W. H. Sweet, R. A. Thompson, and J. R. Green (Eds.), New Perspectives in Cerebral Localisation, Raven Press, New York (1982), pp. 205 - 242.
32. J. Talairach, P. Tournoux, and J. Bancaud, Acta Neurochir., 8, 153 - 250 (1960).
33. J. D. Talbot, S. Marrett, A. C. Evans, et al., Multiple representations of pain in human cerebral cortex, Science,Wash. DC, 251, 1355 - 1358 (1991).
34. Т. Tsubokawa, Motor cortex stimulation for deafferentation pain relief in various clinical syndromes and its possible mechanism, In: J.-M. Besson, G. Guilbaud, and H. Ollat (Eds.), Forebrain areas involved in pain processing, John Libley Eurotext, Montrouge, France (1995).
35. Т. Tsubokawa, Y. Katayama, Т. Yamamoto, Т. Hirayama, and S. Koyama, Chronic motor cortex stimulation in patients with thalamic pain, J. Neurosurg., 78, 393 - 401 (1993).
36. P. D. Wall, M. Devor, R. Inbal, et al., Pain, 7, 103 - 113 (1979).
37. P. D. Wall, R. Melzack (Eds.), Textbook of Pain, 3-rd ed., Churchill Livingstone, Edinburg (1994).
38. J. C. White and W. H. Sweet, Pain and Neurosurgeon, A Forty- Year Experience, Charles C. Thomas, Springfield (1969).
39. J. T. Williams and W. Zieglgansberger, Brain Res., 226, 304 - 308 (1981).
40. W. D. Willis, Anatomy and physiology of descending control of nociceptive responses of dorsal horn neurons: comprehensive review, hi: H. L. Fields, J.-M. Besson (Eds.), Progress in Brain Research, 77 (1988), pp. 1 - 29.
41. R. P. Yezierski, K. D. Gerhart, B. J. Schrock, and W. D. Willis, J. Neurophysiol., 49, 424 - 441 (1983).
42. M. Zimmerman, Pain, 16, 109 - 110 (1983).
Поступила 17.02.03






