Клиническая оценка трансдермальной терапевтической системы с фентанилом при терапии хронической боли у онкологических больных
* J. of Pain and Symptom Management, vol. 16, № 2, 19!
Paul A. Sloan, MD> Dwight E. Moulin, MD, Helen Hays, MD
Фентанил включен в трансдермальную терапевтическую систему (ТТС) со специальной мембраной, регулирующей скорость его выделения. ТТС с фентанилом обеспечивает постоянное поступление в организм этого опиоида на протяжении до 72 ч без использования специального оборудования. После одобрения этическим комитетом 53 пациента с раковой болью, получавшие 45 мг и более перорального морфина в сутки, были включены в открытое проспективное многоцентровое испытание способности ТТС с фентанилом облегчать боль. После недельного периода стабилизации на фоне приема перорального морфина пациентов перевели с морфина на соответствующую (т. е. со скоростью выделения фентанила 25, 50, 75 или 100 мкг/ч) 72-часовую ТТС с фентанилом. ТТС с фентанилом подбирали для каждого в индивидуальном порядке, ориентируясь на выраженность аналгезии; пациенты находились под наблюдением до 3 мес. Ежедневно оценивали облегчение боли и побочные эффекты. В исследование были включены 26 мужчин и 27 женщин, средний возраст которых (±CO) составлял 61 (+ 12) лет; 23 пациента участвовали в 84-дневном исследовании от начала до конца. Средняя продолжительность применения ТТС с фентанилом составила 58+32 дня. Средняя (+ средняя квадратическая ошибка - СКО) суточная доза морфина в последние два дня стабилизации составляла 189 (+ 20) мг, а средняя начальная скорость выделения (доза) фентанила равнялась 58 (+ 6) мкг/ч. Средняя суточная доза морфина, которую пациенты принимали для облегчения сильной боли "по мере необходимости", в конце исследования составила 35 мг. Средняя конечная доза фентанила в конце исследования составила 169 (+ 29) мкг/ч. В период лечения 82 % пациентов оценили облегчение боли как хорошее или отличное. Когда пациентов попросили сравнить облегчение боли в течение первого месяца применения ТТС с фентанилом и облегчение боли при использовании того анальгетика, который они получали перед включением в исследование, то 63 % отдали предпочтение ТТС с фентанилом. К числу побочных эффектов, которые считались связанными с применением ТТС с фентанилом, относились тошнота (13%), рвота (8 %), кожная сыпь (8 %) и сонливость (4 %). На побочные эффекты, связанные с фентанилом, жаловались 30 % пациентов, из них 17% досрочно прекратили использование ТТС.
Мы считаем, что заменяемые каждые 72 ч ТТС с фентанилом являются эффективным и безопасным средством терапии раковой боли и хорошо переносятся пациентами.
Введение
Онкологические пациенты часто нуждаются в регулярном получении опиоидов для облегчения боли. Пероральный морфин по-прежнему считается опиоидом выбора для терапии сильной раковой боли [1]. Следует учитывать, однако, что многие пациенты не могут принимать пероральные препараты [2], у других морфин вызывает непереносимые побочные эффекты, а некоторые могут предпочесть удобную трансдермальную систему, заменяемую каждые 72 ч. Трансдермальная терапевтическая система (ТТС) с фентанилом обеспечивает постоянное поступление в организм этого опиоида без использования специального оборудования. Способность ТТС поддерживать в плазме относительно стабильные уровни фентанила [3] позволяет надеяться на уменьшение частоты и тяжести побочных эффектов опиоидов по сравнению с аналогичными показателями при пероральном приеме опиоидов [4]. ТТС с фентанилом считается альтернативой пероральным опиоидам при терапии раковой боли [5].
Фентанил был создан в 60-х годах в процессе поиска идеального внутривенного анальгетика. Он является синтетическим опиоидом класса фенилпиперидинов и наиболее близок к меперидину. Фентанил широко применяют при хирургических операциях в качестве мощного агониста опиоидных ц-рецепторов, который в 100 раз сильнее морфина. Использование фентанила для терапии других видов боли помимо послеоперационной было ограничено тем, что при внутривенном введении он имеет короткую продолжительность действия. Недавно фентанил был включен в трансдермальную терапевтическую систему со специальной мембраной, которая обеспечивает постоянную скорость выделения этого опиоида. Первые исследования [6, 7] показали, что ТТС с фентанилом удобна для терапии умеренной и сильной хронической боли, поскольку она обеспечивает постоянное контролируемое поступление фентанила в кровь на протяжении до 72 ч. Необходимо, однако, провести дополнительные проспективные исследования для определения эффективности и профиля побочных эффектов ТТС с фентанилом.
Цель настоящего исследования состояла в оценке эффективности и безопасности ТТС с фентанилом при лечении онкологических больных, испытывающих хроническую боль.
Методы
Пациенты. В открытое проспективное многоцентровое исследование способности ТТС с фентанилом облегчать раковую боль были включены взрослые пациенты с хронической раковой болью, нуждавшиеся в опиоидных анальгетиках (эквивалент > 45 мг перорального морфина в сутки). Уровень сознания у всех пациентов был достаточным для эффективного сообщения персоналу о характере своей боли, и все пациенты могли заполнять специально разработанную анкету, касающуюся боли. В исследование не включали пациентов с аллергией к опиоидам, с наличием в анамнезе злоупотребления психотропными препаратами, с активными кожными заболеваниями, делавшими невозможной аппликацию ТТС, а также пациентов с легочной недостаточностью (задержкой СО2), нарушением функции почек (уровень сывороточного креатинина выше 2,0 мг/дл} или печени (уровень сывороточного билирубина выше 2,0 мг/дл}.
Исследование одобрено этическим комитетом, и у всех пациентов перед включением в исследование было получено письменное информированное согласие.
Испытуемые препараты. ТТС с фентанилом представляет собой прямоугольный прозрачный пластырь, содержащий отрывной защитный слой и четыре функциональных слоя. В направлении от наружной поверхности пластыря к коже слои расположены в следующем порядке: наружный защитный слой из полиэфирной пленки, резервуар с фентанилом, мембрана, регулирующая скорость выделения фентанила, и силиконовый липкий слой. ТТС с фентанилом имеют рабочую поверхность 10, 20, 30 и 40 см2, что соответствует выделению 25, 50, 75 и 100 мкг фентанила в час. ТТС с фентанилом наклеивали на верхнюю часть передней поверхности грудной клетки и меняли каждые 72 ч. Пероральный морфин (обычно таблетки по 10 мг) был предоставлен пациентам в качестве "запасного" препарата для быстрого облегчения сильной боли. Никаких других опиоидных анальгетиков помимо перорального морфина пациенты не принимали.
Те пациенты, которые получали стабильные дозы нестероидных противовоспалительных препаратов (НПВП), продолжали принимать эти препараты в той же дозе в течение всего исследования. Пациенты, которые в момент включения в исследование получали стабильные дозы соанальгетиков (снотворные препараты или трициклические антидепрессанты), продолжали принимать эти препараты в назначенной дозе в течение всего исследования. Во время исследования пациентам не назначали новые анальгетики или соанальгетики.
Противорвотные препараты, такие, как прохлорперазин (10 мг), галоперидол (1 мг) и метоклопрамид (10 мг), а также антигистаминные препараты назначали по мере надобности в течение всего исследования.
Структура исследования. Целью открытого многоцентрового исследования была оценка эффективности и безопасности ТТС с фентанилом при терапии хронической раковой боли. Исследование включало две фазы - фазу стабилизации боли морфином и фазу открытого использования ТТС с фентанилом.
Фаза стабилизации. Пациенты, удовлетворявшие критериям включения, получали пероральный морфин для облегчения боли в течение одной недели. В этот период дозу морфина подбирали для каждого пациента в индивидуальном порядке. Потребность пациента в аналгезии считалась стабильной после не менее 7 дней перорального приема морфина, если суммарная суточная доза морфина составляла 45-400 мг при приемлемых побочных эффектах и в последние два дня фазы стабилизации имело место выраженное облегчение боли (оценка интенсивности боли 50 мм и менее по визуальной аналоговой шкале от 0 до 100 мм}. Средняя суточная доза морфина в последние два дня фазы стабилизации значимо не отличалась от средней суточной дозы в начале фазы стабилизации. Это свидетельствует о достижении стабильной суточной дозы перед началом фазы открытого использования ТТС с фентанилом.
Открытая фаза лечения. После периода стабилизации на пероральном морфине всех пациентов перевели с морфина на соответствующую дозу фентанила (25, 50, 75 или 100 мкг/ч); ТТС с фентанилом меняли каждые 3 дня. Пациентов переводили с суточной дозы перорального морфина на ТТС с фентанилом согласно коэффициентам пересчета, показанным в табл. 1. Всем пациентам выдали обычные таблетки морфина (по 10 мг) для неограниченного приема при необходимости быстрого облегчения сильной боли. Пациенты отмечали в дневниках использование дополнительного перорального морфина для быстрого облегчения сильной боли.
Таблица 1
Пересчет скорости выделения (дозы) фентанила из ТТС для пациентов, хронически получающих пероральный морфин
| Пероральный морфин {мг в сутки) | ТТС с фентанилом (мкг/ч) |
45-134 | 25 |
135-224 | 50 |
225-314 | 75 |
315-404 | 100 |
На третий день после аппликации первой ТТС с фентанилом и затем с промежутками до 6 дней корректировали общую дозу фентанила на основании использования дополнительного морфина. Суточную дозу дополнительного перорального морфина от 45 до 130 мг заменяли увеличением дозы фентанила на 25 мкг/ч. Те пациенты, у которых удавалось обеспечивать отличный контроль боли на фоне приема дополнительного морфина в дозе менее 45 мг в сутки без побочных эффектов, продолжали использовать ТТС с первоначальной скоростью выделения фентанила. В тех случаях, когда отличный контроль боли достигался без приема дополнительного перорального морфина, но у пациента возникали слишком сильный седативный эффект или выраженное угнетение дыхания, дозу фентанила снижали с шагом 25 мкг/ч. Мы старались достичь адекватного облегчения боли с использованием как можно более низкой дозы дополнительного морфина и свести к минимуму побочные эффекты.
Максимальная длительность наблюдения за пациентами составляла 84 дня. После начала открытой фазы лечения состояние пациентов оценивали на 3-й день и далее через каждые 6 дней. На протяжении всего исследования пациенты записывали в дневниках количество принятого за сутки морфина и заполняли визуальные аналоговые шкалы (ВАШ, от 0 до 100 мм) для оценки интенсивности боли при пробуждении и перед ночным сном. Кроме того, пациенты дважды в сутки оценивали степень собственного благополучия, используя ВАШ от 0 до 100 мм, на которой крайние значения соответствовали оценкам "очень хорошо" и "очень плохо". Каждый месяц пациенты заполняли шкалу общей оценки облегчения боли из четырех пунктов ("отличное", "хорошее", "удовлетворительное", "неудовлетворительное"). Кроме того, пациенты ежедневно записывали в дневниках побочные эффекты. Общее состояние каждого пациента оценивали один раз в месяц по шкале Karnofsky (см. приложение A). Учитывали также все побочные эффекты.
Статистический анализ. Из-за несравнительного характера настоящего исследования статистические оценки в основном являются описательными. Оценку эффективности осуществляли путем сравнения средней суточной дозы дополнительного морфина в открытую фазу лечения с суточной дозой морфина при завершении фазы стабилизации, применяя двусторонний
Общие оценки пациентом облегчения боли во время каждого визита сравнивали с помощью критерия X2 Фридмана после перевода качественных оценок в числовую форму ("отличное" = 3, "хорошее" = 2, "удовлетворительное" = 1, "неудовлетворительное" = 0). Сравнение пациентами облегчения боли в период с 0-го дня по 28-й день с облегчением боли, которое давал прежний анальгетик, применявшийся до включения пациента в исследование, оценивали с помощью критерия КолмогороваСмирнова по равномерной эмпирической плотности распределения балльных оценок.
Балльные оценки по шкале Karnofsky во время каждого визита сравнивали с помощью критерия X2 Фридмана. Основные физиологические показатели (масса тела, артериальное давление, частота сердечных сокращений и частота дыхания) на 0-й, 28-й, 56-й и 84-й дни оценивали с помощью дисперсионного анализа результатов повторных измерений. В тех случаях, когда общий результат дисперсионного анализа выявлял значимые различия, проводили дополнительное сравнение средних значений в открытой фазе лечения (28-й, 56-й и 84-й дни) со средним значением в 0-й день, используя для этого критерий Даннетта.
Различия считались значимыми на 5%-м уровне (двусторонние критерии).
Результаты
Из 43 пациентов, включенных в исследование (26 мужчин и 27 женщин), 23 полностью завершили 84-дневный протокол. Демографические характеристики пациентов, включенных в исследование, приведены в табл. 2. Средний (±CO - стандартное отклонение) возраст пациентов составлял 61 + 12 лет. Самыми частыми формами рака были рак молочной железы, желудочно-кишечного тракта или легкого. Большинство пациентов (79%) в момент включения в исследование оценивали интенсивность боли как "слегка или умеренно беспокоящую" (табл. 3). Большинство пациентов до включения в исследование принимали пероральный морфин для облегчения боли; наиболее распространенной лекарственной формой морфина был препарат пролонгированного действия (у 62 % пациентов). До включения пациентов в исследование парентеральное введение опиоидов происходило редко.
Таблица 2
Демографические характеристики 53-х пациентов
|
Показатели |
Число пациентов (и %) |
|
Пол: |
|
|
Мужчины |
26 (49,1 %) |
|
Женщины |
27 (50,9 %) |
|
Возраст, лет: |
|
|
<50 |
14 (27,4 %) |
|
51-60 |
8 (15,7 %) |
|
61-70 |
19 (37,3 %) |
|
71-80 |
8 (15,7 %) |
|
80 |
2 (3,9 %) |
|
Данных нет |
2 |
|
Средний ±CO |
61,2±12,4 |
|
Локализация первичной опухоли: |
|
|
молочная железа |
14 (26,9 %) |
|
желудочно-кишечный тракт |
12 (23,1 %) |
|
легкие, бронхи |
9 (17,3 %) |
|
предстательная железа |
4 (7,7 %) |
|
мочевой пузырь, почки |
4 (7,7 %) |
|
множественная миелома |
3 (5,8 %) |
|
другая |
6 (11,5 %) |
|
не указано |
1 |
|
Годы после обнаружения рака: |
|
|
<1 |
16 (30,8 %) |
|
1-3 |
17 (32,7 %) |
|
4-6 |
14 (26,9 %) |
|
7-10 |
3 (5,8 %) |
|
>10 |
2 (3,8 %) |
|
Данных нет |
1 |
|
Среднее ±CO |
3,6 +4,6 |
|
Диапазон |
0,1-29,8 |
Таблица 3
Оценка интенсивности боли и использование анальгетиков в момент включения в исследование
|
Показатели |
Число пациентов |
|
Боль в момент, включения в исследование: |
|
|
отсутствует |
9 (17,3 %) |
|
слегка беспокоящая |
22 (42,3 %) |
|
умеренно беспокоящая |
19 (36,5 %) |
|
очень беспокоящая |
1 (1,9 %) |
|
сильная |
1 (1,9 %) |
|
не указано |
|
|
Анальгетик в момент включения в исследование |
|
|
Пероральныи: |
|
|
MS-Contin |
32 (61,5 %) |
|
Морфин |
9(17,3%) |
|
Гидроморфин |
3 (5,8 %) |
|
Анилеридин |
3 (5,8 %) |
|
Кодеин |
1 (1,9 %) |
|
Ацетаминофен + кодеин |
1 (1,9 %) |
|
Парентеральный: |
|
|
Гидроморфин |
2 (3,8 %) |
|
ТТС с фентанилом |
1 (1,9 %) |
У нескольких пациентов имели место незначительные отклонения от протокола. Один пациент нуждался в ежесуточном приеме 900 мг морфина, но несмотря на это был включен в открытую фазу лечения и одновременно использовал три ТТС с фентанилом, суммарная скорость выделения фентанила из которых составляла 300 мкг/ч. Один пациент перед включением в исследование получал различные опиоиды, включая морфин, гидроморфин, пропоксифен и ТТС с фентанилом. Тем не менее он был переведен на пероральныи морфин во время фазы стабилизации и затем начал использовать ТТС с фентанилом. Два пациента меняли пластырь через каждые 2 дня (а не через 3 дня) в течение 9 и 12 дней соответственно. Один пациент в течение всего исследования продолжал принимать кодеин по поводу головных болей. Три пациента получили одну или две дозы парентеральных опиоидов для облегчения послеоперационной боли (один пациент) или для лечения инфекции (два пациента), не имевшей отношения к исследованию. Один пациент до включения в исследование принимал трициклический антидепрессант для облегчения боли; во время фазы использования ТТС с фентанилом антидепрессант был отменен.
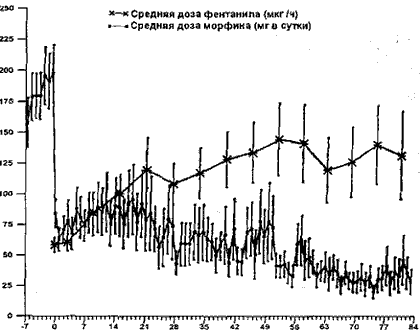
Дни исследования
Рис. 1. Скорость выделения (доза) фентанила из ТТС и суточная доза дополнительного морфина.
На рис. 1 показаны средние суточные дозы морфина и средние скорости выделения (дозы) фентанила из ТТС на протяжении всего исследования. Средняя (± CKO) суточная доза морфина в последние 2 дня фазы стабилизации составила 189±20 мг, а средняя начальная скорость выделений фентанила из ТТС равнялась 58±6 мкг/ч. Средняя (± СКО) суточная доза морфина для быстрого облегчения сильной боли в начале фазы применения ТТС с фентанилом составляла 79 (± 17) мг. В момент завершения исследования средняя (± СКО) суточная доза морфина для быстрого облегчения сильной боли составляла 35 (± 9) мг. В момент завершения исследования средняя конечная доза фен-танила для всех пациентов составляла 169 ±29 мкг/ч. Средняя суточная доза морфина в последние 2 дня фазы стабилизации не имела значимого отличия от средней суточной дозы морфина в момент начала фазы стабилизации.
Средняя (±CO) продолжительность использования ТТС с фентанилом составила 52±32 дня; 62% пациентов использовали ТТС с фентанилом не менее 8 нед. (табл. 4).
Таблица 4
Статус пациентов в отношении завершения исследования (чел. и %)
|
Показатели |
Число пациентов |
|
Продолжительность использования ТТС с фентанилом (дни): |
|
|
<7 |
5 (9,4 %) |
|
7-28 |
11 (20,8 %) |
|
29-56 |
4 (7,5 %) |
|
57-84 |
19 (35,8 %) |
|
>84 |
14 (26,4 %) |
|
Средняя ±СО |
57,9±32,2 |
|
Статус завершения исследования (84 дня): |
|
|
завершили исследование |
23 (43,4 %) |
|
досрочно выбыли из исследования |
30 (56,6 %) |
|
Причины досрочного выбытия из исследова ния: |
|
|
смерть |
4 (7,5 %) |
|
побочные эффекты |
9 (17,0 %) |
|
недостаточное облегчение боли |
8 (15,1 %) |
|
ухудшение состояния |
9 (17,0 %) |
Завершили 84-дневное исследование 23 пациента; 30 пациентов досрочно выбыли из исследования, из них 13 пациентов досрочно выбыли из исследования по причине смерти или из-за ухудшения состояния, не связанного с использованием ТТС.
Повышение дозы фентанила было отмечено у 72 % пациентов; среднее (± СКО) отношение конечной дозы фентанила к начальной дозе составляло 2,9± 0,3. У 26% пациентов не было потребности в повышении дозы фентанила.
В период лечения облегчение боли расценили как "отличное" или "хорошее" 82% пациентов (рис. 2). Среднесуточная (± СКО)
большое и статистически значимое (Р<0,01) снижение массы тела: средняя (± СКО) масса тела в 0-й день составляла 67,9 (± 3) кг, а на 84-й день - 62,6 (± 2) кг. Балльные оценки по шкале Karnofsky оставались относительно стабильными на протяжении всего исследования: средняя оценка (± СКО) составляла 69 (± 2) балла в 0-й день, 68 (± 2) - на 56-й день и 69 (± 3) - на 84-й день.
Обсуждение
Большинство онкологических больных испытывают боль в терминальный период болезни. Краеугольным камнем терапии раковой боли по-прежнему остается регулярный пероральный прием опиоидов, однако многие пациенты не в состоянии принимать пероральные препараты. Один из исследователей высказал предположение, что в терминальной стадии рака половина пациентов нуждается в введении опиоидов по меньшей мере двумя способами [5]. ТТС с фентанилом дают возможность вводить этот опиоид альтернативным способом тем пациентам, которые не могут принимать пероральные препараты или же предпочитают удобный трансдермальный путь введения. Наше исследование показало, что ТТС с фентанилом, заменяемые каждые 3 дня, эффективны, безопасны и хорошо переносятся большинством пациентов с раковой болью. После первого сообщения Miser [8] об использовании ТТС с фентанилом для облегчения боли у пяти онкологических пациентов, эту лекарственную форму фентанила использовали для терапии сильной раковой боли в целом ряде исследований [6, 7, 9-11]. Наше исследование также подтверждает данные об эффективности этого способа терапии раковой боли. ТТС с фентанилом являются удобной, надежной, безболезненной и не требующей специального оборудования альтернативой пероральным опиоидам. По-видимому, необходимо дополнительно обучать врачей применению этого способа терапии раковой боли. В недавнем исследовании по оценке умения медицинского персонала бороться с раковой болью только 24% врачей упомянули ТТС в качестве альтернативы пероральному пути введения опиоидов [12].
В нашем исследовании 8 пациентов прекратили использование ТТС с фентанилом из-за недостаточного облегчения боли. Эта неудача может быть связана с неточным пересчетом дозы перорального морфина в скорость выделения (дозу) фентанила из ТТС или с недостаточным увеличением дозы фентанила. Соотношение пероральный морфин/ТТС с фентанилом, равное 150:1 (табл. 1), выбранное для нашего исследования, сходно с тем, которое использовали Hanks и FaUon [13J, и больше, чем соотношение 100:1, которое использовали в недавнем многоцентровом исследовании Donner и соавт. [10]. Маловероятно, что это исходное соотношение доз привело к получению недостаточных доз фентанила большим числом пациентов. Следует отметить, однако, что индивидуальные различия в фармакокинетике и фармакодинамике могли стать причиной получения некоторыми пациентами недостаточных доз фентанила. Структура нашего исследования позволяла увеличивать дозу фентанила только на 3-й день после первой аппликации ТТС. Вполне возможно, что если бы дозу фентанила можно было повышать каждые 24 ч, как это было предложено в недавнем исследовании [4], то у некоторых пациентов с недостаточным облегчением боли удалось бы достичь приемлемой аналгезии [13]. Недавнее открытое проспективное исследование показало, что использование ТТС с фентанилом для терапии раковой боли при опухолях головы и шеи не дало адекватной аналгезии только у 3 из 50 пациентов [14]. Такая низкая частота отсутствия эффекта может быть объяснена тем, что в упомянутом исследовании дозу фентанила повышали каждые 48 ч, а не каждые 72 ч, как а нашем исследовании.
Частота тошноты и рвоты была сходной во время фазы использования ТТС с фентанилом и во время фазы стабилизации морфином. Следует отметить, однако, что использование ТТС с фентанилом не вызывало запоров. Недавнее исследование продемонстрировало, что при использовании ТТС с фентанилом запоры возникали реже, чем при пероральном приеме морфина [10]. Запор - это не тот побочный эффект, который может ограничить использование опиоидов, тем не менее низкая частота запора при использовании ТТС с фентанилом может существенно улучшить соблюдение пациентами режима терапии. Другие побочные эффекты (седативный эффект, одышка, спутанность сознания, головокружение) наблюдались редко, и две фазы этого исследования не отличались друг от друга по частоте этих эффектов. На протяжении всего исследования ни у одного пациента не было угнетения дыхания. Легкое раздражение кожи наблюдалось у 8% пациентов и могло ограничить использование ТТС только у нескольких пациентов.
Наше исследование продемонстрировало клиническую безопасность ТТС с фентанилом, однако всегда необходимо соблюдать осторожность при использовании любых способов введения в организм сильных опиоидов. Так, сообщалось о передозировке при преднамеренном внутривенном введении фентанила из ТТС [15] и о непреднамеренной передозировке фентанила, связанной со случайным нагревом ТТС [16]. Пациентов и членов их семей необходимо предупредить о том, что вблизи места аппликации ТТС с фентанилом нельзя класть грелки, поскольку это может привести к быстрому всасыванию токсических количеств фентанила.
Использование "дополнительных" опиоидных препаратов для быстрого облегчения сильной боли (помимо регулярного приема опиоида) имеет важное значения для достижения хорошего контроля боли у онкологических пациентов. В этом исследовании мы использовали обычные пероральные таблетки морфина в качестве дополнительного опиоида для быстрого облегчения сильной боли. Тем не менее в будущем необходимо исследовать возможность использования для быстрого облегчения сильной боли лекарственных форм фентанила, всасывающихся через слизистую оболочку полости рта [17]. Этот способ позволит легче и точнее определять индивидуальную потребность пациентов 1 в фентаниле, содержащемся в ТТС. В период использования ТТС с фентанилом суточная доза дополнительного морфина постоянно снижалась. Это может свидетельствовать о лучшем подборе аналгезирующей дозы фентанила с течением времени.
Во время фазы использования ТТС с фентанилом 82% пациентов оценивали облегчение боли как "отличное" или "хорошее", однако интересно отметить, что большинство пациентов не принимало дополнительно морфин в таких дозах, которые полностью устраняли бы боль. В течение исследования средняя оценка пациентами интенсивности боли по ВАЩ колебалась около отметки 28 мм. В количественном отношении такое неполное устранение раковой боли наблюдалось в ряде исследований применения опиоидов для терапии раковой боли, -[18-22]. Поскольку целью терапии раковой боли является полное избавление от нее пациента, то имеет смысл изучить причины в силу которых пациенты не повышают количество получаемых опиоидных анальгетиков до такого уровня, который обеспечивает полное устранение боли. Вполне возможно, что пациенты ограничивают использование дополнительных препаратов в Целях предотвращения побочных эффектов. Другой причиной: может быть желание пациента доставить удовольствие своему врачу или членам семьи, показав им, что он не нуждается в больших количествах дополнительных анальгетиков [23].
У одного пациента возникли симптомы отмены (усиление, боли, приливы) в 1-й день использования ТТС с фентанилом после перехода с 300 мг морфина в сутки на ТТС со скоростью выделения фентанила 75 мкг/ч. Этого пациента исключили, из исследования на 4-й день, и он вновь стал принимать перорально, что более быстрое увеличение дозы фентанила могло бы устранить эти симптомы отмены, однако, следует отметить, что и другие авторы наблюдали симптомы отмены при переводе пациентов с перорального морфина на ТТС с фентанилом [10, 24]. Практикующие врачи должны следить за возникновением симптомов отмены при переводе на ТТС с фентанилом каждого зависимого от опиоидов пациента.
Наше исследование продемонстрировало эффективность ТТС с фентанилом при терапии раковой боли. В исследование, в силу его структуры, включали только взрослых пациентов е раковой болью. В будущем необходимо исследовать использование ТТС с фентанилом для терапии раковой боли у детей.
Данные об использовании опиоидов для терапии хронической боли, не связанной со злокачественными новообразованиями, противоречивы [25]. Поэтому необходимо дополнительное исследование роли ТТС с фентанилом в терапии хронической, нераковой боли.
У большинства пациентов во время исследования дозу фентанила повышали. Однако важно отметить, что только 14% пациентов нуждались в существенном увеличении дозы, в результате которого соотношение фентанила конечная доза/начальная доза было больше 5:1. В недавнем исследовании по-прежнему утверждается, что толерантность к опиоидам препятствует эффективной терапии боли [26]. Толерантность к анальгетическому эффекту опиоидов при терапии раковой боли исключить нельзя, однако у большинства пациентов не наблюдается потребности в быстром увеличении доз опиоидов. Быстрое увеличение доз опиоидов обычно бывает вызвано прогрессированием рака [27]. Мы попрежнему нуждаемся в более полной информации о развитии толерантности к опиоидам при терапии хронической раковой боли.
Обнадеживающим фактом является использование 36 % наших пациентов НПВП перед включением в исследование. НПВП играют роль анальгетиков при терапии раковой боли, особенно при терапии костной боли. Лишь 9 % наших пациентов принимали антидепрессанты в качестве вспомогательной терапии боли перед включением в исследование. Эти препараты рекомендуется применять при терапии раковой боли [28], и, по-видимому, пациенты, участвовавшие в нашем исследовании, использовали их недостаточно широко.
ТТС с фентанилом, заменяемые каждые 3 дня, эффективны, безопасны и хорошо переносятся большинством пациентов с раковой болью. Большинство пациентов, участвовавших в нашем исследовании, отметили, что ТТС с фентанилом облегчала боль .лучше, чем пероральный морфин, который они принимали раньше, или так же, как морфин. Во время использования ТТС с фентанилом возникали типичные опиоидные побочные эффекты, однако запоры наблюдались редко. Этот удобный, простой и безболезненный способ введения в организм опиоида служит прекрасной альтернативой стандартному пероральному приему опиоидов. Будущие исследования с использованием лекарственных форм фентанила, всасывающихся через слизистую оболочку полости рта для быстрого облегчения сильной боли, позволят получить дополнительные данные об индивидуальном подборе ТТС с фентанилом.
Приложение А
Шкала Karnofsky для оценки общего состояния пациента
| Процент функциональной активности | Пояснения | 100 | Хорошее самочувствие. Жалоб нет. Признаков болезни нет | 90 | Пациент может вести обычный образ жизни. Незначительные объективные или субъективные симптомы болезни. | 80 | Ведение обычного образа жизни требует усилий.
Имеются некоторые объективные или субъективные симптомы болезни. Процент функциональной активности |
70 | Пациент способен к самообслуживанию. Не может вести обычный образ жизни или активно работать. | 60 | Время от времени пациент нуждается в посторонней помощи, но может выполнять большинство функций, связанных с самообслуживанием. | 50 | Пациент нуждается в существенной посторонней помощи и в медицинском обслуживании. | 40 | Пациент инвалидизирован. Нуждается в специальном уходе и помощи. | 30 | Выраженная инвалидизация. Показана госпитализация, однако непосредственной угрозы смерти нет. | 20 | Необходима госпитализация, пациент очень слаб, требуется активная поддерживающая терапия. | 10 | Пациент умирает. Летальные процессы быстро прогрессируют. | 0 | Смерть. |
ЛИТЕРАТУРА
1. Jocox A.K, Carr D.B, Payne R. Management of cancer pain. Clinical
practice guideline no. 9. Agency for Healthcare Policy and Research
publication no. 94-0592 Rockfield. MD: Agency for Healthcare Policy
and Research. 1994.
2. Warren D.E. Practical use of rectal medications in palliative care. //J.
Pain Symptom Manage. 1996. 11. 378-387.
3. Portenoy R.K., Southam M.A, Gupta S.K. et al. Transdermal fentanyl
for cancer pain: repeated dose pharmacokinetics. //Anesthesialogy.
1993. 78: 36-43.
4. Korte W., de Stoutz N, , Morant R. Day-to-day titration to initiate
transdermal fentanyl in patients with cancer pain: short - and long-
term experiences in a prospective study of 39 patients. //J. Pain
Symptom Manage. 1996. 11: 139-146.
5. Payne R. Experience with transdermal fentanyl in advanced cancer.
//Eur J. Pain. 1990. 11: 98-101.
6. Herbst L.H., Strause L.G. Transdermal fentanyl use in hospice home-
care patients with chronic cancer pain. //J. Pain Symptom Manage
1992. 7 (Suppl 3). S. 54-57.
7. Zech D.F., Lehmann K.A, Grand S. A new treatment option for chronic cancer pain. // Eur J. Palliat Care. 1994. 1: 26-30.
8. Mtser A.W., Narang P.K., Dothagc JA.> Young R.C., Sinddar W., Miser
J.S. Transdermal fentanyl for pain control in patients with cancer.
//Pain. 1989. 37: 15-21.
9. Zech D.F., Crond S.U., Lynch J., et al. Transdermal fentanyl and ini
tial dose-finding with patient-controlled analgesia in cancer pain. A
pilot study with 20 terminally ill cancer patients. //Pain. 1992. 50: 293-
301.
10. Dormer В., Zenz M., Tryba М., Strumpf M. Direct conversion from oral morphine to transdermal fentanyl: a multicenter study in patients with cancer pain. //Pain. 1996. 64: 527-534.
11. Fainsinger R.L., Bruera E. How should we use transdermal fentanyl (TF) for pain management in palliative care patients? //J. Palliat Care. 1996. 12: 48-53.
12. Sloan P.A., Donnelly M.B., Schwartz R.W., Sloan D.A. Cancer pain assessment and management by housestaff. //Pain. 1996. 67: 475-481.
13. Hanks G.W., Fallen M.T. Transdermal fentanyl in cancer pain: con version from oral morphine [Letter]. //J. Pain Symptom Manage. 1995.
10: 87.
14. Crond S., Zech D., Lehmann K.A., Rodlorch L., Breitmbach H., Hertel D.
Transdermal fentanyl in the long-term treatment of cancer pain a
prospective study of 50 patients wich advanced cancer of the gastro
intestinal tract or the head and neck region. //Pain. 1997. 69: 191-198.
15. DeSio J.M., Bacon D.R., Peer G., Lema M~J. Intravenous abuse of
transdermal fentanyl therapy in a chronic pain patient.
//Anesthesiology. 1993. 79: 1139-1141.
16. Rose P.C., Macfee M.S., Boswell M.V. Fentanyl transdermal system
overdose secondary to cutaneous hyperthermia. //Anesth Anale. 1993
77: 390-391.
17. Ashburn M.A., Fine P.C., Stanley Т.Н. Oral transmucosal fentanyl
citrate for the treatment of breakthrough cancer pain: a case report.
//Anesthesiology. 1989. 71: 615-617. .. Thirlwell M.P., SU
18. Thirl-well M.P., Sloan P.A., Maroun J.A., et al. Pharmacokinetics and
clinical efficacy of oral morphine solution and controlled-release mor
phine tablets in cancer patients. //Cancer. 1989. 65: 2275-2283.
19. Dhaliwal H.S., Sloan P., Arkinstall W.W., et al Randomized evaluation
of controlled-release codeine and placebo in chronic cancer pain. //J.
Pain Symptom Manage. 1995. 10: 612-623.
20. Bruera E.f Sloan P., Mount В., Scott J., Suarez-Almazor M. A ran
domized, double-line, double-dummy, crossover trial comparing the
safety and efficacy of oral sustained-release hydromorphone with
immediate-release hydromorphone in patients with cancer pain. //J.
Clin Oncol. 1996. 14: 1713-1717.
21. Sloan P., Melzack R. Long-term patterns of morphine dosage and pain
intensity in cancer patients. //Can J. Anesth. 1995. 42: A37-B.
22. Hammacfc J.E., Mailliard J.A., Lo-prinzi C.L., et at. Transdermal fen
tanyl in the management of cancer pain in ambulatory patients: an
open-label pilot study. //J. Pain Symptom Manage. 1996. 12: 234-240.
23. Von Roenn J.H., Cleeland C.S., Gonin R., Hatfield A.K., Pandya K.J.
Physician attitudes and practice in cancer pain management. //Ann
Intern Med. 1993. 119: 121-126.
24. Higgs СМ., Vella-Brincat J. Withdrawal with transdermal fentanyl
[Letter] //J. Pain Symptom Manage. 1995. 10: 4-5.
25. Savage S.R. Long-term opioid therapy: assessment of consequences
and risks. //J. Pain Symptom Manage. 1996. 11: 274-286.
26. Santillan R., Maestre J.M., Hurle M.A., Florez J. Enhancement of opi
ate analgesia by nimodipine in cancer patients chronically treated
with morphine: a preliminary report. //Pain. 1994. 58: 129-132.
27. Foley KM. Clinical tolerance to opioids. In: Basbaum. A.J, Besson J.M,
eds. Towards a new pharmacotherapy of pain. John Wiley and Sons
Ltd. 1991. 181-203.
28. Ashburn M.A., Lipman A. Management of pain in the cancer patient.
//Anesth Analg. 1993. 76: 402-416.






