Клинические проявления болевого синдрома при дистальной диабетической полиневропатии
А. Н. Баринов, И. Л. Строков*, Н. Н. Яхно*, Г. Г. Торопина*, Е. А. Дубанова*, М. В. Новосадова**
*Клиника нервных болезней Московской медицинской академии им. И. М. Сеченова,
**кафедра эндокринологии и диабетологии РМАПО
Изучены клинические и нейрофизиологические характеристики болевого синдрома при дистальной диабетической полиневропатии у 100 больных сахарным диабетом типов 1 и 2. Выделены основные клинические симптомокомплексы спонтанных и стимулзависимых болей, неоднородных по своим патофизиологическим механизмам. Сделан вывод о возможности на этом основании стратифицированного подхода к терапии болевого синдрома при диабетической полиневропатии.
Clinical and neurophysiotogical characteristics of the algetic syndrome in case of the distal diabetic polyneuropathy were studied in 100 patients with diabetes mellitus of types 1 and 2. Basic clinical symptom complexes, different in their patho-physiological mechanisms were defined. The conclusion on possibility of the stratified approach to the therapy of the algetic syndrome of diabetic polyneuropathy was made.
Болевой синдром при дистальной диабетической полиневропатии (ДПН) встречается примерно в 18% случаев и относится к наиболее мучительным для пациента и резистентным к терапии проявлениям заболевания [4, 5, 9, 14, 16]. Несмотря на множество публикаций, касающихся клиники и патофизиологии болевой ДПН, систематизация клинических проявлений ДПН с учетом патогенетических механизмов их возникновения до сих пор не проводилась. Принято подразделять симптомы ДПН на "позитивные" (онемение, парестезии, жжение и другие болевые феномены) и "негативные" (гипестезия, выпадение сухожильных рефлексов, парезы), однако при этом не учитываются стимулзависимые компоненты невропатического болевого синдрома [4, 9J. Разделение невропатического болевого синдрома на спонтанный и стимулзависимый с выделением и патофизиологическим обоснованием его отдельных компонентов представляется достаточно важным для изучения болевого синдрома при ДПН [2, 19]. Не изучена взаимосвязь отдельных "позитивных" и "негативных" симптомов между собой и с нейрофизиологическими характеристиками ДПН. Важным шагом к пониманию патогенеза болевого синдрома при ДПН стало разграничение спонтанных болей при поражении толстых и тонких волокон [17]. Показана эффективность метода регистрации соматосенсорных вызванных потенциалов для оценки состояния афферентных систем головного и спинного мозга при ДПН, что позволяет уточнить соотношение центральных и периферических механизмов в генезе отдельных компонентов невропатического болевого синдрома при ДПН [1, 6].
Целью настоящего исследования является изучение клинических и нейрофизиологических особенностей болевого синдрома при ДПН для создания стратифицированного подхода к диагностике и лечению этой патологии.
Пациенты и методы исследования
Обследовано 100 больных с ДПН (25 мужчин и 75 женщин). В исследование включались пациенты с 2А и 2Б стадией ДПН [3, 9]. Диагноз устанавливался на основании анамнеза, типичных жалоб и симптомов и подтверждался электромиогра-фически (ЭМГ). Минимальный возраст был 25 лет, максимальный - 71 год, средний возраст составил 56,2 + 9,1 года. 15 обследуемых страдали сахарным диабетом (СД) типа 1, 85 пациентов - СД типа 2. Средний уровень гликозилированного гемоглобина (НЬА1с) составил 9,4 + 1,8 % (минимальный - 4,7 %, максимальный - 13 %). Исследование соматосенсорных вызванных потенциалов (ССВП) и ЭМГ было также проведено в контрольной группе, состоявшей из 20 здоровых испытуемых. Исследуемая и контрольная группы были сопоставимы по возрасту, полу и росту.
Всем больным проведено исследование неврологического статуса, включавшее: оценку тактильной, болевой, температурной, вибрационной и суставно-мышечной чувствительности в дистальных отделах конечностей; исследование мышечной силы и сухожильных рефлексов. Тактильная чувствительность исследовалась на тыльной поверхности терминальной фаланги большого пальца на ногах и указательного пальца на руках по следующей шкале: отсутствует - больной не чувствует прикосновения ни ватой, ни кисточкой, ни рукой; резко снижена - пациент не чувствует прикосновения ватой, но чувствует прикосновение кисточкой или рукой; умеренно снижена - чувствительность к прикосновению ватой сохранена, но меньше чем в проксимальных отделах; нормальная - хорошо чувствует прикосновение ватой. Оценка степени нарушения вибрационной чувствительности проводилась на тыльной поверхности терминальной фаланги большого пальца на ногах и указательного пальца на руках с использованием градуированного 128 Гц камертона по 8-балльной шкале с учетом возраста больного. Температурная чувствительность исследовалась на тех же точках стопы и кисти с помощью инструмента "Тиотерм".
Оценка состояния чувствительности проводилась по следующей шкале: отсутствует - больной не чувствует температурной разницы при прикосновении металлической и пластмассовой сторонами инструмента; резко снижена - пациент ошибается в определении температурной разницы при прикосновениях длительностью не менее 2 с; умеренно снижена - чувствительность сохранена, но меньше чем в проксимальных отделах; нормальная - больной без ошибки определяет температурную разницу. Болевая чувствительность исследовалась в тех же точках стопы и кисти с помощью укола иглой по следующей шкале: отсутствует - больной не чувствует укола; резко снижена - пациент ошибается в определении острого и тупого укола; умеренно снижена - чувствительность сохранена, но меньше чем в проксимальных отделах; нормальная - чувствительность не изменена. Суставно-мышечная чувствительность исследовалась в суставах терминальных фаланг большого пальца стопы и указательного пальца кисти. При исследовании стимулзависимой боли оценивалось наличие аллодинии (с помощью беличьей кисточки), динамической гиперпатии на укол иглой и статической гиперпатии на надавливание и тупое поколачивание. Оценка интенсивности отдельных компонентов спонтанной боли и крампи проводилась с использованием визуально-аналоговой шкалы (ВАШ) с последующим пересчетом по 10-балльной системе. Поскольку у пациентов исследовались двигательные и чувствительные функции на обеих ногах и руках, число наблюдений и выборке составило 200.
Коротколатентные и длиннолатентные церебральные ССВП исследовали на приборе фирмы "Nicolet" с программным обеспечением "Bravo" для вызванных потенциалов в ответ на электрическую стимуляцию срединного нерва в области запястья и малоберцового нерва в области медиальной лодыжки по стандартной методике. При регистрации ранних компонентов (РК) ССВП усредняли 1000 ответов в полосе пропускания усилителя 0,5-1000 Гц за эпоху анализа 100 мс. Стимулы подавались с частотой 5 Гц и интенсивностью, соответствующей порогу двигательного ответа большого пальца. При стимуляции рук измеряли амплитуду и латентные периоды (ЛП) компонентов РО, NO, P1, N1, Р2, N2; ног - P1, N1, Р2, N2. Для исследования поздних компонентов РЗ, N3, Р4, N4 использовали две интенсивности стимула: на пороге двигательного ответа и субъективной переносимости болевого восприятия. Межстимульный интервал случайно варьировал от 1 до 4 с, усредняли 50 ответов за эпоху анализа 500 мс. Полосу пропускания усилителя устанавливали в диапазоне 0,5-200 Гц.
Электромиографическое исследование проводили на приборе фирмы МБН (Россия) по стандартной методике. Исследовали двигательные нервы (п. peroneus, n. tibialis) наиболее пораженной ноги - оценивали скорость распространения возбуждения и амплитуда М-ответа (негативная фаза), а также сенсорный нерв (п. suralis) - оценивали амплитуду потенциала действия при антидромной стимуляции. Температурный режим кожи поддерживался в пределах 32-33 °С.
Результаты исследования
В структуре болевого синдрома при ДПН выделено два основных компонента: спонтанные и стимулзависимые боли. В исследуемой группе спонтанные боли были представлены следующими симптомами: парестезии в ногах - 94 %, в руках - 39 %; жжение в ногах - 89 %, в руках - 25 %; стреляющие боли в ногах - 84 %, в руках - 15 %; ноющие боли в ногах - 83 %, в руках - 33 % случаев. Кроме этого, отмечались: онемение в ногах - 100 %, в руках - 39 %; зябкость в ногах - 73 %, в руках - 24 %; зуд в ногах - 54 %, в руках - 28 % случаев.
Из стимулзависимых болей при ДПН выявлены: динамическая гипералгезия на укол иглой в ногах у 58 %, в руках - у 25 % пациентов; статическая гипералгезия на надавливание и тупое поколачивание: в ногах - у 45 %, в руках - у 15 % больных; аллодиния в ногах - у 38 %, в руках у 10 % пациентов.
При качественной оценке отдельных компонентов болевого синдрома при ДПН были выявлены следующие их особенности.
Боль в виде жжения, чаще поверхностная, имела уровень от низкой до высокой степени интенсивности, четко описывалась пациентом (употреблялись термины: "печет", "горит", "ошпарено кипятком", "обожжено крапивой"). Жжение чаще возникало в вечернее время и ночью в покое, но могло появляться и днем после физической нагрузки при ходьбе.
Боли ноющего, ломящего, тянущего, выкручивающего характера чаще ощущались как глубокие, имели в большинстве случаев средний уровень интенсивности, возникали в покое в вечернее и ночное время и сопровождались повышенной двигательной активностью - больные были вынуждены двигать ногами, массировать их для уменьшения интенсивности неприятных ощущений. Ноющие боли, возникающие в икроножных мышцах при ходьбе, связаны с ишемией и являются симптомом ангиопатии, поэтому исключались из анализируемого материала.
Стреляющие боли, чаще кратковременные, длящиеся от секунды до 1-2 мин, описывались пациентами как "чувство прохождения электрического тока , укол длинной иглой , пронзающие боли", "дергающие боли", иногда - "пульсирующие боли". Этот вид боли чаще появлялся в дневное и вечернее время при ходьбе, при движениях в конечностях, иногда - самопроизвольно. Стреляющие боли имели глубокую локализацию и высокую интенсивность.
Онемение часто описывалось пациентами как неприятное ощущение стянутости, "отсиженности", "одеревенелости", ватности в конечности. Часто больные жаловались, что нога "как будто покрыта коркой", "на ногу одеты двое толстых носков", "между пальцами проложены валики", при ходьбе пациенты не чувствовали пола и т. д. Эти ощущения были чаще поверхностные, локализованы дистально по типу "носков" и "перчаток".
Парестезии описывались пациентами как неприятное поверхностное ощущение покалывания, "ползанья мурашек", "пузырьков газировки" и т. д. Парестезии чаще возникали параллельно с онемением, когда онемение начинало проходить, но могли появляться и отдельно от него.
Зуд локализовался в ступнях и подошвах, а также на тыльной стороне кистей и стоп, в предплечьях и голенях. При этом вовсе не обязательно было наличие зуда в половых органах, складках кожи или других характерных для сахарного диабета местах.
Зябкость описывалась пациентами как неприятное чувство холода в дистальных отделах конечностей, возникающее даже в теплом помещении. Нередко зябкость возникала сразу после жжения, или, наоборот, в ряде случаев эти два ощущения появлялись одновременно в разных участках тела (например, зябкость в тыле стоп и жжение в подошвах). Эти ощущения могли быть как поверхностными, так и глубокими, чаще имели уровень от низкой до средней степени интенсивности по ВАШ.
Аллодиния описывалась пациентами как повышенная нежность, чувствительность кожи, возникновение неприятных ощущений, боли жгучего или саднящего характера при легком соприкосновении с постельным бельем, одеждой, шерстью домашних животных, иногда она вызывалась даже легким движением воздуха. Больные использовали такие термины, как "обсосанные ноги", "ошпаренная кожа", "содранная кожа", "прикосновение наждачной бумагой" и другие. При клиническом исследовании зона аллодинии определялась в дистальных отделах конечностей на границе нормальной и сниженной тактильной чувствительности. Сами больные отмечали обострение феномена аллодинии в вечернее и ночное время.
Динамическая гипералгезия на укол иглой выявлялась при исследовании болевой чувствительности на границе зон с нормальной и сниженной чувствительностью на укол иглой.
Статическая гипералгезия на надавливание и тупое поколачивание часто ощущалась пациентами как болезненность при надавливании на икроножные мышцы и мышцы предплечий. Часто из-за этих ощущений больные отказывались от проведения массажа и других физиотерапевтических мероприятий.
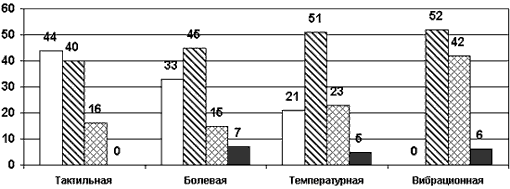
Структура чувствительных расстройств в ногах у пациентов, страдающих болевой формой ДПН.
По оси ординат - проценты. Светлые столбики - нормальная; столбики с косой штриховкой - снижена; с перекрестной штриховкой - резко снижена; темные столбики - отсутствует.
На рисунке представлены нарушения чувствительности при ДПН (в порядке убывания сохранности): вибрационной, температурной, болевой и тактильной гипестезии. Снижение суставно-мышечного чувства отмечалось лишь у 18 % больных.
Двигательные нарушения были представлены снижением (37 %) или выпадением (54 %) дистальных сухожильных рефлексов и крампи (54 %), парезы дистальной мускулатуры нижних конечностей встречались редко (8 %). Поражение ног было у всех больных, рук - у 39 % пациентов. Изолированного поражения рук при ДПН не наблюдалось.
Различия в структуре чувствительных расстройств и болевого синдрома в клинической картине ДПН при разных типах сахарного диабета отсутствовали, что может свидетельствовать о единстве патофизиологических механизмов формирования болевого синдрома в рамках ДПН при типах 1 и 2 СД. Характер и выраженность болевого синдрома не были связаны с длительностью СД и ДПН, а также с уровнем гликемии. Единственным компонентом болевого синдрома при ДПН, который коррелировал с уровнем НЬА1с (r = 0,75, р < 0,05) был зуд. Отмечалось прогрессирующее снижение отдельных видов как поверхностной, так и глубокой чувствительности и вовлечение в патологический процесс верхних конечностей по мере увеличения длительности заболевания ДПН.
Для оценки участия центральных механизмов в генезе болевого синдрома при ДПН проведен анализ изменений ССВП [6]. Выявлено достоверное увеличение латентных периодов ранних компонентов ССВП. Установлена положительная связь между сохранностью глубоких видов чувствительности и степенью изменения амплитуд и ЛП ранних компонентов ССВП: чем ниже тактильная и вибрационная чувствительность, тем больше ЛП и меньше амплитуда ответов. Это согласуется с периферическим уровнем поражения нервной системы при ДПН и указывает на недостаточность афферентации по быстропроводящим волокнам. Обнаружено снижение амплитуд поздних компонентов и выявлена положительная корреляция между значением амплитуд ПК и степенью сохранности болевой и температурной чувствительности, а также выраженностью жжения и зябкости.
Обсуждение
В настоящее время в зарубежной и отечественной литературе принято подразделять невропатические боли при ДПН на два основных подвида: обусловленные поражением "малых" (тонких слабомиелинизированных А-5 волокон и немиелинизированных С-волокон) и "толстых" (А-В) волокон. К первым относят спонтанные жгучие и стреляющие боли, а поражение толстых волокон, по мнению ряда авторов, сопровождается появлением стимулзависимых болей (прежде всего аллодинии) и парестезии [5, 19]. Такая селективность болевых ощущений объясняется нарушением центральной модификации сенсорного импульса при поражении различных типов волокон [12]. Большинство естественных ощущений являются смешанными, так, легкое прикосновение вызывает активацию разных типов медленно реагирующих и быстро реагирующих механорецепторов: при ожоге активируются и окончания Руффини и ноцицепторы, а болевой холодовой стимул возбуждает ноцицепторы и луковицы Краузе. В норме стимулы разных модальностей пересекаются в ЦНС и здесь происходит их модификация: подавление одного компонента позволяет другому достичь уровня сознательного восприятия [20].
Придерживаясь этой теории и основываясь на собственных клинических и нейрофизиологических данных, мы сопоставили спонтанные, стимулзависимые боли и чувствительные нарушения, что позволило нам выделить три патогенетически разных симптомокомплекса.
Первый симптомокомплекс представлен дизестезическими болями (жжением, стреляющими болями), зябкостью, болевой и температурной гипестезией, динамической гипералгезией на угол иглой. Эти симптомы связаны с поражением тонких волокон, проводящих температурную и болевую чувствительность. Зябкость и жжение патофизиологически различаются лишь степенью заинтересованности симпатической нервной системы и соотношением центральных и периферических механизмов на фоне поражения С-афферентов. Развитие симпатически обусловленной жгучей боли, по-видимому, связано с двумя механизмами.
Во-первых, после повреждения периферического нерва на мембранах поврежденных и неповрежденных аксонов С-волокон начинают появляться отсутствующие в норме альфа-адренорецепторы, чувствительные к циркулирующим катехоламинам, выделяющимся из терминалей постганглионарных симпатических волокон [2]. Во-вторых, повреждение нерва вызывает прорастание симпатических волокон в узел заднего корешка, где они оплетают в виде "корзинок" тела чувствительных нейронов и таким образом активация симпатических терминалей провоцирует активацию чувствительных волокон [19]. В основе развития симпатически не обусловленной спонтанной боли (зябкость, стреляющие боли) также лежит активация первичных С-афферентов и Аb-афферентов за счет аккумуляции и перераспределения тетродотоксин-нечувствительных натриевых каналов по длине аксона. Повышение плотности натриевых каналов ведет к развитию очагов эктопического возбуждения, как в аксоне, так и в самой клетке, которые начинают генерировать усиленные разряды потенциалов действия. Кроме того, после поражения нерва и поврежденные и интактные афференты приобретают способность генерировать эктопические разряды за счет активации тетродонечувствительных натриевых каналов, что приводит к развитию патологической импульсации из аксонов и нейронов поврежденных афферентов [8, 19|.
Второй симптомокомплекс включает трункальные (ноющие, ломящие) боли и статическую гипералгезию на перкуссию и тупое надавливание, сюда же можно отнести и зуд в дистальных отделах конечностей. Считается, что возникновение трункальной боли связано с дисфункцией слабо-миелинизированных А-5 волокон, а статическая гипералгезия возникает вследствие активации так называемых "спящих" ноцицепторов С-волокон [8, 11, 19]. У человека эти афференты составляют около 20 % от всех С-афферентов, в норме они не активны (являются "спящими") в здоровых тканях, но дают мощный ответ на выброс болевых медиаторов в условиях развития реакции воспаления. Предполагается, что при ДПН ноцицепторы становятся чувствительными за счет биологически активных веществ, синтезирующихся и высвобождающихся из шванновских клеток вследствие срабатывания механизма "переключения фенотипа", который заключается в нарушении дифференциации глиальных клеток из-за снижения ретроградного аксоплазматического транспорта нейротрофических факторов при ДПН [6]. Этими веществами являются серотонин, гистамин, нейроактивные пептиды (субстанция Р и полипептид типа кальцитонина), кинины, брадикинин, а также продукты метаболизма арахидоновой кислоты (простагландины Е2, Е2а, простациклин, тромбоксан А2 и лейкотриены) и цитокины [8, 18]. Зуд в дистальных отделах конечностей, включенный в данный симптомокомплекс, как было указано выше, связан с гипергликемией, вследствие которой происходят сенситизация и подпороговое раздражение ноцицепторов. Таким образом, выявление этого симптома позволяет диагностировать не только особенности болевого синдрома у пациента, но и своевременно выявлять декомпенсацию углеводного обмена.
Третий симптомокомплекс возникает при поражении толстых волокон и объединяет онемение и парестезии, тактильную и вибрационную гипестезию, а также аллодинию. Появление аллодинии связано со стимуляцией низкопороговых механорецепторов Ар-волокон на фоне центральной сенситизации нейронов широкого афферентного диапазона, локализованных в основании задних рогов спинного мозга (4, 5 и 6 пластины по Рекседу). Эти нейроны играют ключевую роль в обработке и передаче в восходящем направлении ноцицептивной информации, а также в реализации низко интегрированных простейших реакций на повреждающее воздействие. На активность этих нейронов оказывает влияние не только возбуждающая периферическая афферентация, но и активность соседних нейронов, обеспечивающая тормозящий эффект на возбудимость всего рецептивного поля [10]. Таким образом, уменьшение сенсорной не болевой афферентации при ДПН приводит к снижению "окружающего" торможения и может лежать в основе аллодинии [7]. Другим механизмом и анатомическим субстратом аллодинии является феномен "регенеративного ветвления" А-волокон в заднем роге спинного мозга, которое индуцируется атрофией С-афферентов при ДПН. Поскольку в норме нейроны II пластины получают только ноцицептивную информацию, то поступление не болевой стимуляции по Ар-волокнам может ошибочно расцениваться нервной системой как боль [19]. Это согласуется с данными нейрофизиологического исследования: при анализе изменений ССВП у больных с аллодинией получено достоверное снижение амплитуды N18, при этом амплитуда и ЛП последующих компонентов ССВП достоверно не изменялись [6]. Таким образом, данные ССВП указывают на преимущественное поражение при аллодинии скорее толстых волокон, нежели ноцицептивных С-афферентов. Выраженное снижение объема информации по быстропроводящим волокнам лемнисковой системы, по-видимому, компенсируется за счет афферентации по более медленно проводящим волокнам, усиление которой на фоне центральной сенситизации может ошибочно расцениваться нервной системой как боль.
Проведенная систематизация клинических проявлений ДПН и объединение их в отдельные симптомокомплексы по патогенетическому принципу позволяют сделать первый шаг к стратификации подходов к лечению болевой ДПН, выстраивая алгоритм анальгетической терапии в зависимости от преобладающего вида болевого синдрома.
Литература
- Карпович Е. И., Густое А. В., Лукушина Е. Ф. Оценка состояния соматосенсорной афферентации у подростков с болевой диабетической полиневропатией // Тезисы Российской науч.-практ. конф. "Патологическая боль". - Новосибирск, 1999. - С. 25.
- Новиков А. В., Солоха О. А. Невропатическая боль // Нев-рол. журн. - 2000. - № 1. - С. 56-62.
- Строков И. А., Баринов А. Н., Новосадова М. В. и др. Клинические методы оценки тяжести диабетической полиневропатии // Там же. - № 5. - С. 14-19.
- Строков И. А., Баринов А. Н. Диабетическая невропатия // Там же. - С. 47-55.
- Строков И. А., Баринов А. Н. Клиника, патогенез и лечение болевого синдрома при диабетической полиневропатии // Там же. - 2001. - № 6. - С. 47-55.
- Торопина Г. Г., Баринов А. Н., Яхно Н. Н. Соматосенсорные вызванные потенциалы при диабетической полиневропатии // Там же. - 2002. - № 3. - С. 42-50.
- Archer A. G., Watkins P. J., Thomas P. К. et al. The natural history of acute painful diabetic neuropathy // J. Neurol. Neu-rosurg. Psychiatry. - 1983. - Vol. 46. - P. 491-499.
- Besson J. The neurobiology of pain // Lancet. - 1999. - Vol. 353. - P. 1610-1615.'
- Dyck P. J., Dyck P. J. B. Diabetic polyneuropathy // Diabetic Neuropathy / Eds P. J. Dyck, P. K. Thomas. - 2-nd Ed. -Philadelphia: W. B. Saunders, 1999. - P. 255-278.
- Hillmann P., Wall P. D. Inhibitory and excitatory factors controlling lamina 5 cells // Exp. Brain Res. - 1969. - Vol. 9. - P. 284-291.
- Marchettini P. Muscle pain: animal and human experimental and clinic studies // Muscle and Nerve. - 1993. - Vol. 16. - P. 1033-1039.
- Ochoa J. L. Sensory mechanisms in peripheral nerve disease // Peripheral Neuropathy / Ed. Didier Cros. - Philadelphia: Lippincott Williams & Wilkins, 2001. - P. 294-302.
- Rask C. A. Biological actions of Nerve Growth Faxtor in the peripheral nervous system // Eur. Neurol. - 1999. - Vol. 41, suppl. 10. - P. 14-19.
- Testfaye S. Painful diabetic neuropathy // Contemporary Endocrinology, Clinical Management of Diabetic Neuropathy / Ed. A. Veves. - Totowa, NJ: Humana Press Inc., 1999. - P. 133-146.
- Torebjork H. E., La Motte L. H., Robinson C. J. Peripheral nerve correlates of magnitude of cutaneous pain and hyperal-gesia: Simultaneous recordings of human sensory judgements of pain and evoked responses of nociceptor С fibres // J. Neu-rophysiol. - 1984. - Vol. 51. - P. 325.
- Verdugo P., Ochoa J. L. Placebo response in chronic, causalgi-form, neuropathic pain patients // Pain Rev. - 1994. - Vol. 1. - P. 33-46.
- Vinic A. I., Park T. S., Stansberry K. G. et al. Diabetic neuropathies // Diabetologia. - 2000. - Vol. 43. - P. 957- 973.
- Willis A. L., Cornelsen M. Repeated injection of prostaglandin E, in rat induced chronic swelling and marked decrease in pain threshold // Prostaglandins. - 1973. - Vol. 3. - P. 353-360.
- Woolf C. J., Mannion R. J. Neuropathic pain: aethiology, symptoms, mechanisms and management // Lancet. - 1999. - Vol. 353. - P. 1959-1964.
- Yarnitsky D., Ochoa J. L. Release of cold-induced burning pain by block of cold-specific sensory input // Brain. - 1990. - Vol. 113. - P. 893-902.
Индийский фактор






